
���� �ٵڢٲ���CrԪ�صĻ��ϼ��ڷ�Ӧǰ���Ϊ+6�ۣ�
�ڽ�ϵ����غ���㣻
�۵ڢ۲��и�������Ӧ���ɳ�����
��� �⣺�ٵڢٲ���CrԪ�صĻ��ϼ��ڷ�Ӧǰ���Ϊ+6�ۣ�����������ԭ��Ӧ���ʴ�Ϊ����
�ڵڢڲ��У���ԭ1molCr2O72-���ӣ��ɵ����غ��֪����ҪFeSO4•7H2O�����ʵ���Ϊ$\frac{1mol��2����6-3��}{��3-2��}$=6mol���ʴ�Ϊ��6��
�۵ڢ۲��и�������Ӧ���ɳ��������ӷ�ӦΪCr3++3OH-=Cr��OH��3�����ʴ�Ϊ��Cr3++3OH-=Cr��OH��3����
���� ���⿼��������ԭ��Ӧ��Ϊ��Ƶ���㣬���շ�Ӧ��Ԫ�صĻ��ϼ۱仯Ϊ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע���ϵ����غ���㣬��Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮɹ�� | B�� | ú������ | C�� | ʯ���ѻ� | D�� | ������ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ӵ�ˮ����ȡ���ʵ�ʱ����������ˮ�Ҵ�����CCl4 | |
| B�� | �����ؽᾧ�ɶԴֱ���������ᴿ | |
| C�� | �����ú˴Ź�������������1-������2-����� | |
| D�� | ʵ�������ᴿ��������������Ҵ����ɲ����ȼ���ʯ�ң����˺�������ķ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ��е���78.5�棬����ˮ�ƾ�ֱ�Ӽ���������Ƶ���ˮ�ƾ� | |
| B�� | ��ȥ������̼�����л��е������Ȼ������壬���Խ�����ͨ������̼��������Һ | |
| C�� | �����ô����ȥ��¯�е�ˮ������Ҫ�ɷ�Ϊ̼��ƣ� | |
| D�� | ��������������������ɹ��ˮ�õ��Ĵ���ת��Ϊ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
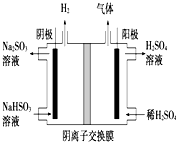 ���Ṥҵ��SO2��ȡSO3�ķ�ӦΪ��2SO2+O2 $?_{����}^{����}$2SO3��H=-47kJ/mol����ͬ�¶��£���Ӧ��ƽ�ⳣ�������
���Ṥҵ��SO2��ȡSO3�ķ�ӦΪ��2SO2+O2 $?_{����}^{����}$2SO3��H=-47kJ/mol����ͬ�¶��£���Ӧ��ƽ�ⳣ�������| �� �� | 200��300��400�� |
| ƽ�ⳣ�� | K1 K2 K3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
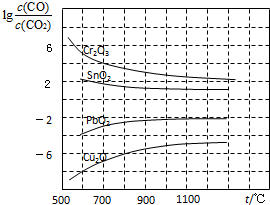 ��ʮ��������ѧ�����߶�̼�����������˹㷺������о���ȡ����һЩ��Ҫ�ɹ���
��ʮ��������ѧ�����߶�̼�����������˹㷺������о���ȡ����һЩ��Ҫ�ɹ����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��0.1mol/L Na2CO3��Һ�У�CO32-����ĿС��0.1NA�� | |
| B�� | ��״���£�6.0 g���Ậ��0.3 NA��C-H�� | |
| C�� | 32gCu��������Ƴ�ַ�Ӧ��ת��NA������ | |
| D�� | 31g���ף�P4���к���6 NA�����ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ��Ӧʱ��/min | n��CO��/mol | n��H2O��/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
| A�� | ��Ӧ��t1min�ڵ�ƽ������Ϊv��H2��=$\frac{0.40}{t_1}$mol/��L•min�� | |
| B�� | ���������������䣬��ʼʱ�������г���0.60molCO��1.20molH2O������ƽ��ʱn��CO2��=0.40 mol | |
| C�� | ���������������䣬��ƽ����ϵ����ͨ��0.20molH2O����ԭƽ����ȣ��ﵽ��ƽ��ʱCOת��������H2O�����������С | |
| D�� | �¶�����1000�棬������Ӧƽ�ⳣ��Ϊ1.6��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com