
| A. | 乙醇沸点是78.5℃,将含水酒精直接加热蒸馏可制得无水酒精 | |
| B. | 除去二氧化碳气体中混有的少量氯化氢气体,可以将气体通过饱和碳酸氢钠溶液 | |
| C. | 可以用醋酸除去锅炉中的水垢(主要成分为碳酸钙) | |
| D. | 仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐 |
分析 A.酒精与水易形成共沸混合物;
B.HCl与碳酸氢钠反应生成二氧化碳;
C.醋酸与碳酸钙发生强酸制取弱酸的反应;
D.粗盐中钙镁离子等不能利用物理方法除去.
解答 解:A.酒精与水易形成共沸混合物,不能直接蒸馏,应加CaO后蒸馏,故A错误;
B.HCl与碳酸氢钠反应生成二氧化碳,则气体通过饱和碳酸氢钠溶液可除杂,故B正确;
C.醋酸与碳酸钙发生强酸制取弱酸的反应,则可以用醋酸除去锅炉中的水垢,故C正确;
D.粗盐中钙镁离子等不能利用物理方法除去,则仅采用物理方法无法将晾晒海水得到的粗盐转变为精盐,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,涉及混合物分离提纯、除杂等,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
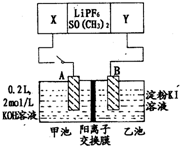 已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )
已知高能锂电池的总反应式为:2Li+FeS═Fe+Li2S[LiPF6.SO( CH3)2为电解质],用该电池为电源进行如图的电解实验,电解一段时间测得甲池产生标准状况下H2 4.48L.下列有关叙述不正确的是( )| A. | 从隔膜中通过的离子数目为0.4 NA | |
| B. | 若电解过程体积变化忽略不计,则电解后甲池中溶液浓度为4 mol/L | |
| C. | A电极为阳极 | |
| D. | 电源正极反应式为:FeS+2Li++2e-═Fe+Li2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1的A1Cl3溶液中:Na+、K+、CO32-、NO3- | |
| B. | pH=13的溶液中:Na+、NH4+、Cl-、NO3- | |
| C. | c(OH-)=1×10-13mol•L-1的溶液中:Mg2+、K+、Cl-、SO42- | |
| D. | 无色透明溶液中:Ca2-、NH4+、MnO4-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定呈碱性 | |
| C. | 某无色溶液中加入BaCl2溶液,再加稀盐酸,沉淀不溶解,原溶液中一定有SO42- | |
| D. | 某无色溶液中加入酚酞试液变红,该溶液一定是碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22gCO2气体中所含分子数大于0.5NA | |
| B. | 1LCO2和1LCO所含分子数相同 | |
| C. | 等质量的O2和O3,所含的原子数一定相等 | |
| D. | 1mol•L-1的NaOH溶液中Na+数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性氧化物均为金属氧化物 | |
| B. | 一种元素可能有多种氧化物,但是同种化合价只对应一种氧化物 | |
| C. | 酸根离子中不可能含有金属元素 | |
| D. | 还原产物只有还原性,氧化产物只有氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用水溶解后过滤分离 | B. | 用稀盐酸溶解过滤分离 | ||
| C. | 用稀硫酸溶解过滤分离 | D. | 用酒精灯加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com