
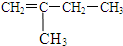 和Br2发生加成反应时,产物的结构简式为
和Br2发生加成反应时,产物的结构简式为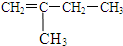 和Br2发生加成反应时生成
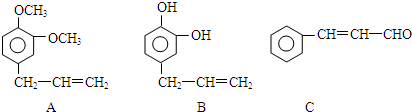
和Br2发生加成反应时生成 ;
; .
.


科目:高中化学 来源: 题型:
| A | B | C | D | E | F | |
| 主要化合价 | -1 | -3、+5 | -2、+6 | -1、+7 | +2 | +1、+2 |
| 原子半径nm | 0.071 | 0.11 | 0.102 | 0.099 | 0.197 | 0.117 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、把电能转变为化学能,使溶液发生氧化还原反应 |
| B、电子从活泼金属流向不活泼金属,不活泼金属为负极 |
| C、外电路中电子从负极流向正极 |
| D、正极发生氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com