
【题目】某实验兴趣小组模拟工业制备高铁酸钾(K2FeO4)并测定产品纯度,涉及反应
①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O
②Na2FeO4+2KOH=K2FeO4+2NaOH
已知高铁酸钾易溶于水,微溶于浓 KOH 溶液;在强碱性溶液中稳定,酸性至弱碱性条件下,与水反应放出氧气。
Ⅰ.制备 NaClO,实验装置如下图。
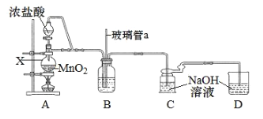
(1)仪器 X 的名称为____。
(2)B中盛装的液体是____,玻璃管 a 的作用是____。
Ⅱ.制备 K2FeO4 晶体
第①步:将制得的 NaClO 溶液转移到大烧杯中,依次加入适量 NaOH 和 FeCl3 溶液,得 Na2FeO4;
第②步:加入适量 KOH 固体至饱和,得湿产品;
第③步:洗涤、干燥,得 K2FeO4 晶体。
(3)第②步中能得到湿产品的原因是___。
(4)第③步“洗涤”时,洗涤剂不用蒸馏水,而采用 95%的乙醇,原因是_______。
Ⅲ.测定 K2FeO4 纯度
测定制得的 K2FeO4 的纯度可用滴定法,滴定时有关反应的离子方程式为: a.FeO![]() +CrO
+CrO![]() +2H2O=CrO
+2H2O=CrO![]() +Fe(OH)3↓+OH-
+Fe(OH)3↓+OH-
b.2CrO![]() +2H+=Cr2O
+2H+=Cr2O![]() +H2O
+H2O
c.Cr2O![]() +6Fe2++14H+=2Cr3++6Fe3++7H2O
+6Fe2++14H+=2Cr3++6Fe3++7H2O
(5)称取 2.0g 制得的 K2FeO4 产品溶于适量 KOH 溶液中,加入足量 KCrO2,充分反应后过滤,将滤液转移到 250mL 容量瓶定容。取 25.00mL 定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠做指示剂,用 0.10mol·L-1(NH4)2Fe(SO4)2 标准溶液滴定,终点由紫色变为绿色。重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液的体积为26.00 mL。则标准液应选用______ (填“酸式”或“碱式”)滴定管,该 K2FeO4 样品的纯度为 _____。
【答案】蒸馏烧瓶 饱和食盐水 平衡压强 相同条件下,K2FeO4溶解度小于 Na2FeO4 K2FeO4易溶于水且与水反应,95%乙醇能减少 K2FeO4溶解损失 酸式 85.8%
【解析】
本实验的目的是模拟工业制备高铁酸钾(K2FeO4)并测定产品纯度;首先制备NaClO,装置A中利用浓盐酸和二氧化锰固体共热制取氯气,产生的氯气中混有HCl气体,可在装置B中盛放饱和食盐水将HCl除去,之后通入C中与NaOH溶液反应制取NaClO,装置D吸收未反应的氯气;然后制备K2FeO4晶体,将制得的NaClO溶液转移到大烧杯中,依次加入适量NaOH和FeCl3溶液,得Na2FeO4;由于相同条件下,K2FeO4溶解度小于 Na2FeO4,所以向Na2FeO4溶液中加入适量KOH的固体至饱和,可以析出K2FeO4晶体,之后经过滤、洗涤、干燥得到K2FeO4晶体;之后用滴定法测定K2FeO4晶体的纯度。
(1)根据仪器X的结构特点可知其为蒸馏烧瓶;
(2)B中盛装饱和食盐水除去氯气中混有的HCl气体;玻璃管a与大气相通,可以平衡压强,防止装置内压强过高;
(3)参考侯德榜制碱法可知,相同条件下,K2FeO4溶解度小于 Na2FeO4,所以向Na2FeO4溶液中加入适量KOH的固体至饱和,可以析出K2FeO4晶体;
(4)高铁酸钾易溶于水,与水反应放出氧气,用蒸馏水洗涤会造成产品的溶解损失,所以用95%的乙醇洗涤降低损失;
(5)(NH4)2Fe(SO4)2标准液中存在铵根和Fe2+的水解使溶液显酸性,所以需要用酸式滴定管;根据方程式c可知n(Cr2O![]() )=
)=![]() n[(NH4)2Fe(SO4)2],根据方程式a、b可知25.00mL待测液中n(FeO
n[(NH4)2Fe(SO4)2],根据方程式a、b可知25.00mL待测液中n(FeO![]() )=
)=![]() n(Cr2O
n(Cr2O![]() ),所以n(FeO
),所以n(FeO![]() )=
)=![]() n[(NH4)2Fe(SO4)2]=0.026L×0.10mol/L×
n[(NH4)2Fe(SO4)2]=0.026L×0.10mol/L×![]() =
=![]() mol,所以样品中n(K2FeO4)=
mol,所以样品中n(K2FeO4)=![]() mol×
mol×![]() =
=![]() mol,所以样品的纯度为
mol,所以样品的纯度为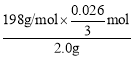 ×100%=85.8%。
×100%=85.8%。


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】实验室制备1,2-二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2= CH2
CH2= CH2![]() CH2=CH2+Br2
CH2=CH2+Br2![]() Br2CH2CH2Br
Br2CH2CH2Br
用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如图所示:

有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是______;
a.引发反应 b.加快反应速度 c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入________,其目的是吸收反应中可能生成的酸性气体;
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在_______层(填“上”、“下”);
(4)若产物中有少量副产物乙醚.可用_____________的方法除去。
(5)下列关于装置的说法正确的是___________________________;
a.图中仪器a的侧面导管有利于液体顺利滴落
b.B的长导管可防止反应出现堵塞情况
c.B有防倒吸作用
(6)以1,2—二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2—二溴乙烷通过( ① )反应制得( ② ),②通过( ③ )反应制得氯乙烯,由氯乙烯制得聚氯乙烯。
①______________(填反应类型)
②________________(填该物质的电子式)
③______________(填反应类型)写出第一步的化学方程式_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是( )
A. 稀硫酸与0.1 mol/L NaOH溶液反应:H+(aq)+OH-(aq)= H2O(l)△H = +57.3 kJ·mol-1
B. 在101KPa下氢气的燃烧热△H =-285.5 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) △H = +285.5 kJ·mol-1
C. 已知2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1, 则可知C的燃烧热大于110.5 kJ·mol-1
D. 2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
4NO2(g)+O2(g) ΔH>0 反应为熵增反应,任何温度下能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1个某种氯原子的质量是a g,1个12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
①该氯原子的相对原子质量为12a/b ②m g该氯原子的物质的量为m/(aNA) mol ③该氯原子的摩尔质量是aNA g ④a g该氯原子所含的电子数为17 mol
A.①②B.①③C.②③D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的平衡常数K值和温度的关系如表:
温 度(℃) | 360 | 440 | 520 |
K值 | 0.036 | 0.010 | 0.0038 |
(1)①由上表数据可知该反应为_____ (填放热,吸热,无法确定 )反应。
②下列措施能用勒夏特列原理解释是_____(填序号)。
a.增大压强有利于合成氨 b.使用合适的催化剂有利于快速生成氨
c.生产中需要升高温度至500°C左右 d.需要使用过量的N2,提高H2转化率
(2)0.2mol氨气溶于水后再与含有0.2mol硫酸的溶液反应放热QkJ,请你用热化学方程式表示其反应式_____。
(3)常温时,将amol氨气溶于水后,再通入bmol氯化氢,溶液体积为1L,且c(NH4+)=c(Cl﹣),则一水合氨的电离平衡常数Kb=_____(用ab表示)。
(4)原料气H2可通过反应 CH4(g)+H2O (g)![]() CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的
CO(g)+3H2(g) 获取,已知该反应中,当初始混合气中的![]() 恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
恒定时,温度、压强对平衡混合气CH4含量的影响如图所示:
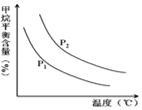
①图中,两条曲线表示压强的关系是:P1_____P2(填“>”、“=”或“<”)。
②其它条件一定,升高温度,氢气的产率会__(填“增大”,“减小”减小,“不变”不变)。
(5)原料气H2还可通过反应CO(g)+H2O(g)![]() CO2(g)+H2(g)获取。
CO2(g)+H2(g)获取。
①T℃时,向容积固定为5L的容器中充入1mol水蒸气和1mol CO,反应达平衡后,测得CO的浓度为0.08molL﹣1,该温度下反应的平衡常数K值为_____。
②保持温度仍为T℃,容积体积为5L,改变水蒸气和CO的初始物质的量之比,充入容器进行反应,下列描述能够说明体系处于平衡状态的是_____(填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n(CO):n(H2O):n(CO2):n(H2)=1:16:6:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示,其中R元素是短周期中除稀有气体之外原子半径最大的元素。下列说法正确的是
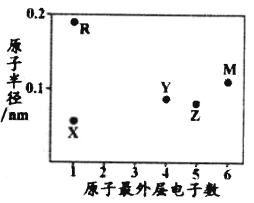
A. M元素在周期表中的位置是第2周期第ⅥA族
B. 元素的最高价氧化物对应水化物的酸性:Z<Y
C. X元素与Y、Z、M三种元素只能各形成一种共价化合物
D. Y、R的单质分别都能与其他物质反应置换出X单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组查阅资料知:苯和液溴在有溴化铁(FeBr3)存在的条件下可发生反应生成溴苯和溴化氢,此反应为放热反应。他们设计了下图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中。
如图是制取溴苯的装置。试回答:

(1)装置A中发生反应的化学方程式是_________________________。
(2)装置C中看到的现象是____________________,证明________________________。
(3)装置B是吸收瓶,内盛CCl4液体,实验中观察到的现象是________,原因是____________。
如果没有B装置而将A、C直接相连,你认为是否妥当?________(填“是”或“否”),理由是______________________。
(4)实验完毕后将A试管中的液体倒在装有冷水的烧杯中,烧杯______________(填“上”或“下”)层为溴苯,这说明溴苯______________且______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作对应的实验现象及解释或结论都正确的是( )
选项 | 实验操作 | 实验现象 | 解释或结论 |
A | 向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液 | 溶液变为黄色 | 氧化性:H2O2>Fe3+ |
B | 向5mL1mol/L NaOH溶液中滴加5滴1mol/L MgCl2溶液,然后再滴加足量的1mol/L CuCl2溶液 | 先产生白色沉淀,然后产生蓝色沉淀 | Ksp[Cu(OH)2] >Ksp[Mg(OH)2] |
C | 将充满NO2的密闭玻璃球浸泡在热水中 | 红棕色变深 | 2NO2(g) |
D | 向一定量酸性KMnO4溶液中加入乙二醇(HOCH2CH2OH) | 溶液紫色褪去 | 乙二醇被氧化为乙二酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,向20mL均为0.1mol·L-1的MOH和NH3·H2O混合液中滴加0.1mol·L-1的CH3COOH溶液,测得混合液的电阻率(表示电阻特性的物理量)与加入CH3COOH溶液的体积(V)的关系如图所示。已知:CH3COOH的Ka=l.8×10-5,NH3H2O的Kb=l.8×l0-5。下列说法错误的是( )
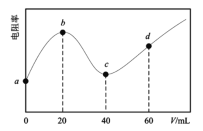
A.碱性:MOH>NH3·H2O
B.c点溶液中浓度:c(CH3COOH)>c(NH3H2O)
C.d点溶液的pH≈5
D.a→d过程中水的电离程度先减小后增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com