
【题目】质量为ag的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝不变红,质量大于a g的是( )
A. 盐酸B. CH3COOHC. C2H5OHD. NaOH
【答案】D
【解析】
质量为ag的铜丝,在空气中灼热变黑,是生成了CuO:2Cu+O2![]() 2CuO,再结合CuO与选项中的物质发生的化学反应来分析判断。
2CuO,再结合CuO与选项中的物质发生的化学反应来分析判断。
A、质量为ag的铜丝,在空气中灼热变黑,立即放入盐酸中,CuO与盐酸反应,生成铜盐,质量减少,故A错误;
B、质量为ag的铜丝,在空气中灼热变黑,立即放入CH3COOH中,CuO与CH3COOH反应,生成铜盐,质量减少,故B错误;
C、质量为ag的铜丝,在空气中灼热变黑,立即放入C2H5OH中,CuO与C2H5OH反应:CuO+C2H5OH![]() CH3CHO+Cu+H2O,反应前后其质量不变,故C错误;
CH3CHO+Cu+H2O,反应前后其质量不变,故C错误;
D、质量为ag的铜丝,在空气中灼热变黑,立即放入NaOH中,CuO、Cu与NaOH不反应,质量增加,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】已知![]() 和
和![]() 可以相互转化
可以相互转化![]()
![]() 。现将一定量
。现将一定量![]() 和
和![]() 的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
的混合气体通入体积为1L的恒温恒容的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是
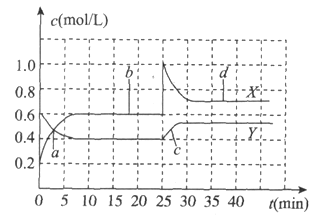
A. 反应进行至25min时,曲线发生变化的原因是加入0.4mol![]()
B. a、b、c、d四个点中,表示化学反应处于平衡状态的点是b和d
C. 图中共有两条曲线X和Y,其中曲线X表示![]() 浓度随时间的变化
浓度随时间的变化
D. 若要达到与d相同的状态,在25min时还可以采取的措施是适当缩小容器体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
下列说法不正确的是
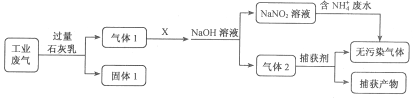
A. 固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B. X可以是空气,且需过量
C. 捕获剂所捕获的气体主要是CO
D. 处理含NH4+废水时,发生反应的离子方程式为:NH4++NO2-==N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。

(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对工、农业生产和国防都有重要意义。 已知:N2(g)+3 H2(g)2NH3(g) △H= -92.4kJ/mol,请回答:
(1)合成氨工业中采取的下列措施可以用平衡移动原理解释的是________(填字母)。
a. 用铁触媒加快化学反应速率
b. 采用较高压强(20MPa~50MPa)
c. 采用较高温度(500℃左右)
d. 将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1mol N2和3mol H2并发生反应。
①若容器容积恒定,达到平衡时,N2的转化率α1 =25%,此时,反应放热______kJ,容器内气体压强与开始时气体压强之比是________。
②若容器压强恒定,则达到平衡时,容器中N2的转化率α2______α1(填“>”“<”或“=”)。
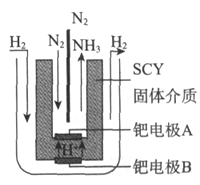
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递![]() )为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如图)。钯电极A为_________极(填“阴”或“阳”),该极上的电极反应式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水综合利用的工艺流程如图所示(粗盐中的可溶性杂质有MgC12、CaC12、Na2SO4)。下列说法错误的是

A. 步骤①加入试剂的顺序:水→NaOH溶液→Na2CO3溶液→BaC12溶液→过滤后加盐酸
B. 步骤②的操作是在氯化氢气流中加热MgC12·6H2O
C. 从步骤③到步骤⑤的目的是为了浓缩富集溴
D. 火力发电厂燃煤排放的含SO2的烟气经处理后可用在步骤④反应中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对饱和AgCl溶液(有AgCl固体存在)进行下列操作后,c(Ag+)和Ksp(AgCl)均保持不变的是
A.加少量水稀释B.加热
C.加入少量盐酸D.加入少量AgNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应4A(g)+5B(g)![]() 4C(g)+6D(g),取4 mol A和5 mol B置于容积为5 L的密闭容器中,20 s后,测得容器内A的浓度为0.4 mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
4C(g)+6D(g),取4 mol A和5 mol B置于容积为5 L的密闭容器中,20 s后,测得容器内A的浓度为0.4 mol·L-1。则此时B、C的浓度是多少?若以物质D来表示这段时间的反应速率应为多少?__________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com