
【题目】2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,Na2O2(s)+CO2(g)===Na2CO3(s)+![]() O2(g) ΔH=-226 kJ·mol-1,根据以上热化学方程式判断,下列说法正确的是( )。
O2(g) ΔH=-226 kJ·mol-1,根据以上热化学方程式判断,下列说法正确的是( )。
A. CO的燃烧热为283 kJ
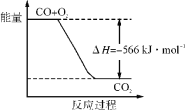
B. 下图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023
【答案】C
【解析】
A.燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出热量;已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,一氧化碳的燃烧热为283kJ/mol,单位错误,故A错误;
B.由热化学方程式,2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol,可知图象中一氧化碳和氧气物质的量为1、![]() ,物质的量不符合反应物质的物质的量,故B错误;
,物质的量不符合反应物质的物质的量,故B错误;
C.固体二氧化碳变化为气体二氧化碳需要吸热,焓变放热是负值,由2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-226kJ/mol,所以反应2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>-532kJ/mol,故C正确;
D.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol;②Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ/mol;即Na2O2(s)+CO(g)=Na2CO3(s)△H=-509kJ/mol;CO(g)与Na2O2(s)反应放出
O2(g)△H=-226kJ/mol,依据盖斯定律②×2+①得到:2Na2O2(s)+2CO(g)=2Na2CO3(s)△H=-1018kJ/mol;即Na2O2(s)+CO(g)=Na2CO3(s)△H=-509kJ/mol;CO(g)与Na2O2(s)反应放出![]() ×509 kJ=254.5kJ热量时,反应的一氧化碳物质的量为0.5mol,电子转移数为6.02×1023,故D错误。
×509 kJ=254.5kJ热量时,反应的一氧化碳物质的量为0.5mol,电子转移数为6.02×1023,故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】在下列各组物质中,找出合适的序号填在对应的空格内:
①白磷和红磷 ②NO2和N2O4 ③12C和14C ④![]() 和
和 ![]() ⑤C60和金刚石 ⑥异戊烷和新戊烷
⑤C60和金刚石 ⑥异戊烷和新戊烷 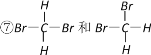
⑴互为同位素的是_____________;⑵互为同分异构体的是__________;
⑶互为同素异形体的是_________;⑷同一种物质的是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的SO2、NOx等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)NOx和SO2在空气中存在下列平衡:
2NO(g)+ O2(g) 2NO2(g) △H= -112 kJ·mol-1,
2SO2(g)+ O2 (g) 2SO3(g) △H= -196 kJ·mol-1;
SO2通常在NO2的存在下,进一步被氧化,生成SO3。写出NO2和SO2反应的热化学方程式为________________________________。
(2)烟气中的SO2可以用NaOH溶液吸收,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)

①图中a极要连接电源的_______(填“正”或“负”)极,C口流出的物质是_______。
②SO32-放电的电极反应式为_____________________________________。
(3)常温下,烟气中SO2被NaOH溶液吸收可得到NaHSO3、Na2SO3等。
①已知Na2SO3水溶液显碱性,原因是_____________________________________(写出主要反应的离子方程式),该溶液中c(Na+)_________ 2c(SO32-)+ c(HSO3-)(填“>”“<”或“=”);
②常温下,0.1mol/L的NaHSO3溶液的pH=6,则c(SO32-)- c(H2SO3)= _________ mol/L(填写准确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、铝是重要的金属材料,铁、铝及其化合物有非常重要的用途。
(1)下列说法正确的是________(填序号)。
① 配制氯化铁溶液,先将FeCl3固体溶于较浓盐酸,再用蒸馏水稀释到所需的浓度
② FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③ 利用氯水和KSCN溶液可以检验Fe3+中有无Fe2+
④ 加热蒸干Fe2(SO4)3溶液获得Fe2(SO4)3固体
⑤ 含a mol AlCl3的溶液和含1.5a mol NaOH的溶液,无论正滴和反滴,生成Al(OH) 3的质量相等
⑥ 由于金属铝性质稳定,所以Al在空气中能稳定存在
(2)高铁酸钾(K2FeO4)是一种高效多功能水处理剂。其作用原理为__________________。
(3)以铝土矿(主要成分为Al2O3和Fe2O3、SiO2)为原料制备铝的一种工艺流程如下:
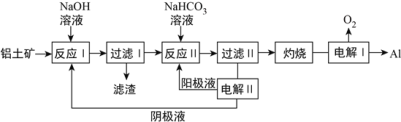
①滤渣主要成分为___________________
②在实验室灼烧操作应选择的实验仪器为_____________________
③反应II中,加入NaHCO3一段时间才有沉淀生成,写出加入少量NaHCO3时发生反应的离子方程式________。
(4)已知25 ℃时Ksp[Cu(OH)2]=2.2×1020,Ksp[Fe(OH)3]=4.0×1038, Ksp[Al(OH)3]=1.1×1033。
①在25 ℃下,向浓度均为0.1 mol·L1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式)。
②溶液中某离子物质的量浓度低于1.0×105 mol·L1时,可认为已沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+完全沉淀时,测定c(Al3+)=0.2 mol·L1。此时所得沉淀中________(填“还含有”或“不含有”)Al(OH)3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 某些花岗石产生氡(22288Rn),该元素的相对原子质量为222
B. Se是人体必需的微量元素, 7834Se和8034Se互为同位素
C. F2通入氯化钠溶液中,生成的主要气体为O2
D. 136CNMR(核磁共振)可用于含碳化合物的结构分析,![]() C的中子数为7
C的中子数为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物 ![]() 的分子式均为C8H8,下列说法不正确的是 ( )
的分子式均为C8H8,下列说法不正确的是 ( )
A. 甲、乙、丙的二氯代物数目最少的是丙
B. 甲、乙、丙中只有甲的所有原子可能处于同一平面
C. 甲、乙、丙在空气中燃烧时均产生明亮并带有浓烟的火焰
D. 等量的甲和乙分别与足量的溴水反应,消耗Br2的量:甲>乙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核安全与放射性污染防治已引起世界各国的广泛重视。在爆炸的核电站周围含有放射性物质碘131和铯137。碘131一旦被人体吸入,可能会引发甲状腺疾病。
(1)Cs(铯)的价电子排布式为6s1,与铯同主族的前四周期(包括第四周期)的三种元素X、Y、Z的第一电离能如下表:
元素代号 | X | Y | Z |
第一电离能/(kJ·mol-1) | 520 | 496 | 419 |
上述三种元素X、Y、Z的元素符号分别为________,基态Z原子的核外电子排布式为________,X形成的单质晶体中含有的化学键类型是________。
(2)F与I同主族,BeF2与H2O都是由三个原子构成的共价化合物分子,二者分子中的中心原子Be和O的杂化方式分别为________、________,BeF2分子的立体构型是________,H2O分子的立体构型是________。
(3)与碘同主族的氯具有很强的活泼性,能形成大量的含氯化合物。BCl3分子中B—Cl键的键角为________。
(4)131I2晶体的晶胞结构如图甲所示,该晶胞中含有________个131I2分子;KI的晶胞结构如图乙所示,每个K+紧邻________个I-。

甲 乙
(5)KI晶体的密度为ρ g·cm-3,K和I的摩尔质量分别为MK g·mol-1和MIg·mol-1,原子半径分别为rKpm和rIpm,阿伏加德罗常数的值为NA,则KI晶胞中原子的体积占晶胞体积的百分率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率的说法中,正确的是( )
A. 反应C(s)+H2O(g)![]() CO(g)+H2(g),增加碳的用量可加快反应速率
CO(g)+H2(g),增加碳的用量可加快反应速率
B. 用铁片与稀硫酸反应制H2,改用98%的浓硫酸可加快生成H2的速率
C. 用锌片与稀盐酸反应,加入适量的NaCl溶液,反应速率不变
D. 反应2SO2(s)+O2(g)![]() 2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
2SO3(g)在密闭容器中进行,压缩容器体积,反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组欲进行如下的实验探究金属与浓硫酸反应。试回答下列问题
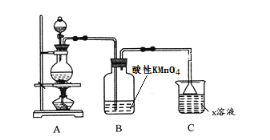
(1)利用上图装置研究铜与浓硫酸反应,A装置反应的化学方程式为_________________。B装置反应的化学方程式为__________________________,C装置的作用是_________________________。
(2)将上述实验中的铜改为铁,在常温下进行,无明显现象,其原因是__________________。在加热条件下,实验的后阶段可观察到倒立的漏斗边沿有气体冒出,该气体可能为____________________。
验证该气体的实验方案如下:

①装置连接顺序:X→ _________________________;
②能证明上述假设成立的实验现象是_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com