
【题目】一定条件下,向一带活塞的密闭容器中充入1 mol N2和3 mol H2,发生下列反应:N2(g)+3H2(g)![]() 2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是
2NH3(g),反应达到平衡后,改变下述条件,NH3平衡浓度不改变的是
A. 保持温度和容器压强不变,充入1 mol NH3(g)
B. 保持温度和容器体积不变,充入1 mol NH3(g)
C. 保持温度和容器压强不变,充入1 mol N2(g)
D. 保持温度和容器体积不变,充入1 mol H2(g)
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】可逆反应mA(g)![]() nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是
nB(g)+pC(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合右图中的两个图像,以下叙述正确的是

A. m>n,Q>0 B. m>n+p,Q>0 C. m<n+p,Q<0 D. m>n,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任何温度下均能自发进行的是
A. 2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B. Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
C. HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D. H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学概念在逻辑上存在如下关系:

对下列概念的说法正确的是
A. 化合物与纯净物属于重叠关系
B. 分解反应与复分解反应属于并列关系
C. 化合物与金属氧化物属于交叉关系
D. 钠盐与碳酸盐属于并列关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)能判断反应达到平衡状态的依据是__________(填字母序号)。
A.2 ν逆(H2) = ν 正(CO)
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.容器内CO、H2、CH3OH的浓度之比为1:2:1
F.CO、H2、CH3OH的速率之比为1:2:1
(2)CO在不同温度下的平衡转化率与压强的关系如图1,该反应△H_______0(填“>”或“<”)
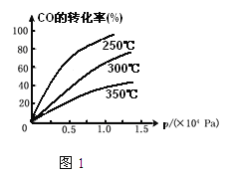
(3)一定温度下,将4a mol H2和2a mol CO放入2L的密闭容器中,充分反应后测得CO的转化率为50%,则:
①该反应的平衡常数为_______________。
②若此时再向该容器中投入a mol CO、2a mol H2和a mol CH3OH,判断平衡移动的方向是_______________(“正向移动”、“逆向移动”或“不移动”);
③在其他条件不变的情况下,将容器体积压缩到原来的![]() ,与原平衡相比,下列有关说法正确的是_____________(填字母)。
,与原平衡相比,下列有关说法正确的是_____________(填字母)。
A.H2的浓度减小; B.正反应速率加快,逆反应速率也加快;
C.甲醇的物质的量增加; D.重新平衡时,![]() 增大;
增大;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:a.C2H2(g)+ H2(g)= C2H4(g)ΔH<0
b. 2CH4(g)= C2H4(g)+ 2H2(g)ΔH>0
判断以下3个热化学方程式:
①C(s)+ 2H2(g)= CH4(g)ΔH1
②C(s)+ ![]() H2(g)=
H2(g)= ![]() C2H2(g)ΔH2
C2H2(g)ΔH2
③C(s)+ H2(g)= ![]() C2H4(g)ΔH3
C2H4(g)ΔH3
ΔH1、ΔH2、ΔH3由大到小的顺序是( )
A. ΔH2 >ΔH3 >ΔH1 B. ΔH3 >ΔH2 >ΔH1
C. ΔH3 >ΔH1 >ΔH2 D. ΔH1 >ΔH2 >ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验现象,所得结论正确的是( )

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式__________。
(2)下列三种情况下,离子方程式与(1)相同的是____(填序号)。
A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液中显中性
B.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO![]() 恰好完全沉淀
恰好完全沉淀
C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(3)若缓缓加入稀硫酸直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)可近似地用右图中的___曲线表示(填序号)。
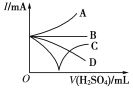
(4)若有一表面光滑的塑料小球悬浮于Ba(OH)2溶液中央,如图所示,向该烧杯里缓缓注入与Ba(OH)2溶液等密度的稀硫酸至恰好完全反应。在此实验过程中,小球将____________。
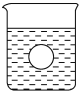
Ⅱ.某地甲、乙两厂排放污水,污水中含有下列8种离子中的4种:Ag+、Ba2+、Fe3+ 、Na+、Cl-、SO42-、NO3-、OH-(两厂所排污水不含相同离子)。两厂单独排放都会造成严重的水污染(其中甲厂的污水是碱性的),如将两厂的污水按一定比例混合,沉淀后的污水变成无色澄清的几乎只含硝酸钠的溶液而排放,污染程度会大大降低。关于两厂所排污水中所含的4种离子,你认为应该是:甲厂:________;乙厂________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com