
| A、1L0.1mol?L-1的氨水中有0.1NA个NH4+ |
| B、标准状况下,22.4L盐酸含有NA个HCl分子 |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为0.5NA |
| D、标准状况下,6.72LNO2与水充分反应转移的电子数目为0.2NA |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
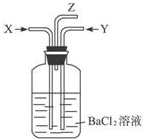
| A、①④ | B、①② | C、②③ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、84% | B、16% |
| C、69% | D、31% |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、N2的电子式: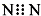 | ||
B、中子数为18的氯原子结构示意图: | ||
C、质子数为53,中子数为78的碘原子:
| ||
| D、NaHCO3在水溶液中的电离方程式:NaHCO3 ═Na++H++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向海带灰浸出液中加入稀硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B、NaHSO3的水解:HSO3-+H2O?S032 -+H3O+ |
| C、四氧化三铁固体溶解在稀硝酸溶液中:Fe3O4+8H+═2Fe3++Fe2++4H2O |
| D、向小苏打溶液中加入少量Ba(OH)2:Ba2++HCO3-+OH -=BaCO3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用电极电解少量的MgCl2溶液:2H2O+2Cl-
| ||||
| B、向氢氧化亚铁中加入足量的稀硝酸:Fe(OH)2+2H+═Fe2++2H2O | ||||
| C、向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、用食醋除去水瓶中的水垢:CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
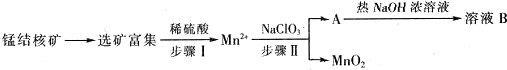
| 实验 | ① | ② | ③ | ④ |
V(HNO3)/mL | 50 | 100 | 150 | 200 |
| V(NO)/L | 1.344 | 2.688 | 3.36 | 3.36 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com