
【题目】图1表示:以相同的滴速分别向同体积的蒸馏水和0.1 mol/L CuSO4溶液中滴入NaCl溶液,氯离子浓度随氯化钠加入量的变化关系。图2表示:CuCl2溶液中氯离子浓度随温度变化关系。结合信息,下列推断不合理的是
已知:CuSO4溶液中存在平衡X:Cu2++4H2O![]() [Cu(H2O)4]2+(蓝色)
[Cu(H2O)4]2+(蓝色)
CuCl2溶液呈绿色,溶液中存在平衡Y:4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O
[CuCl4]2-+4H2O

A.平衡Y是图1中两条曲线没有重合的主要原因
B.由图2可知平衡Y为吸热反应
C.平衡X是无水硫酸铜粉末和硫酸铜溶液颜色不同的原因
D.CuCl2溶液加水稀释,溶液最终变为浅绿色
【答案】D
【解析】
A.以相同的滴加速度滴加相同浓度的NaCl溶液,CuSO4溶液中Cl-浓度增加的慢,是由于发生反应Y,消耗了Cl-,A正确;
B.由图2可知:升高温度,CuCl2溶液中氯离子浓度降低,说明升高温度,化学平衡4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O正向移动;根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,该反应的正反应为吸热反应,B正确;
[CuCl4]2-+4H2O正向移动;根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动,该反应的正反应为吸热反应,B正确;
C.无水硫酸铜粉末是白色固体,当固体溶于水时,与水发生反应产生[Cu(H2O)4]2+,使溶液显蓝色,因此平衡X的存在导致无水硫酸铜粉末和硫酸铜溶液显示不同的颜色,C正确;
D.CuCl2溶液呈绿色,加水稀释,4Cl-+[Cu(H2O)4]2+![]() [CuCl4]2-+4H2O的平衡逆向移动,[Cu(H2O)4]2+的浓度增大,溶液会逐渐变为蓝色,D错误;
[CuCl4]2-+4H2O的平衡逆向移动,[Cu(H2O)4]2+的浓度增大,溶液会逐渐变为蓝色,D错误;
故答案选D。


科目:高中化学 来源: 题型:
【题目】将2.56gCu和一定量的浓HNO3反应,随着Cu的不断减少,反应生成气体的颜色逐渐变浅,当Cu反应完毕时,共收集到气体1.12L(标准状况),则反应中消耗HNO3的物质的量为( )
A.0.05molB.1molC.1.05molD.0.13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是典型微生物燃料电池原理示意图。若用含硝酸盐废水替代图中氧气,可达到废水处理的目的(已知:a室中微生物降解有机物产生e-、CO2和H+)。关于该电池,下列说法不正确的是
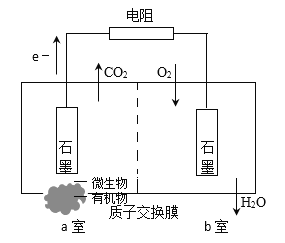
A.H+通过质子交换膜从a室进入b室
B.a室内发生氧化反应,电极为正极
C.b室内发生的电极反应为:O2+4e-+4H+=2H2O
D.将硝酸盐转化为N2时,电极反应为:2NO3-+10e-+12H+=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学设计了如图装置制取溴苯和溴乙烷:
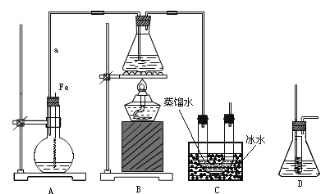
已知:乙醇在加热的条件下可与HBr反应得到溴乙烷(CH3CH2Br),二者某些物理性质如下 表所示:
溶解性(本身均可作溶剂) | 沸点(℃) | 密度(g/mL) | |
乙醇 | 与水互溶,易溶于有机溶剂 | 78.5 | 0.8 |
溴乙烷 | 难溶于水,易溶于有机溶剂 | 38.4 | 1.4 |
请回答下列问题:
(1)B中发生反应生成目标产物的化学方程式为______。
(2)导管a的作用是______。
(3)反应完毕后,U形管内的现象是______;分离溴乙烷时所需的玻璃仪器是______。
(4)简述实验中用纯铁丝代替铁粉的优点:______。
(5)实验完成后,某同学在溴乙烷中加入NaOH乙醇溶液并加热,为判断其发生的是水解 反应还是消去反应,该同学设计了甲、乙两个方案:
方案甲:向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应
方案乙:向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则证明发生了消去反应。
则有关上述实验方案的叙述(_____)
A 方案甲正确 B 方案乙正确 C 两个方案都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备:C4H10(g)![]() C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
C4H8(g)+H2(g) △H。该反应平衡转化率、反应温度及压强的关系如图,下列说法正确的是
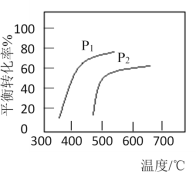
A.该反应△S<0
B.压强P1<P2
C.该反应为吸热反应,平衡常数随温度升高而降低
D.使用催化剂可加快反应速率,使平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
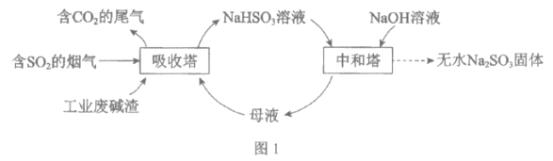
已知:H2SO3、HSO3-、SO32-在水溶液中的物质的量分数随pH的分布如图2, Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
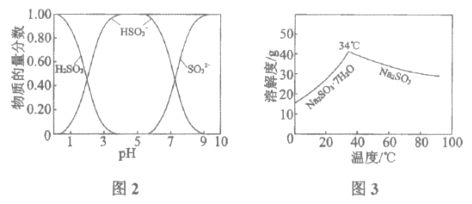
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:______________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为______________。
②NaHSO3溶液中c(SO32-)>c(H2SO3),结合方程式解释其原因:____________。
③已知下列反应:
SO2(g)+2OH-(aq)=SO32-(aq)+H2O(l) ![]()
CO2(g)+2OH-(aq)=CO32-(aq)+H2O(l) ![]()
2HSO3-(aq)=SO32-(aq)+SO2(g)+H2O(l) ![]()
吸收塔中Na2CO3溶液吸收SO2生成HSO3-的热化学方程式是______________。
④吸收塔中的温度不宣过高,可能的原因是______________(写出1种即可)。
(3)制备无水Na2SO3:将中和塔中得到的Na2SO3溶液______________(填操作),过滤出的固体用无水乙醇洗涤、干燥,得无水Na2SO3固体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋约占地球表面积的71%,海水资源的利用前景广阔,从海水中提取镁的主要步骤如图所示,下列说法正确的是
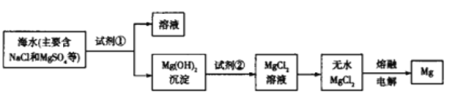
A.工业上利用NaOH溶液使Mg2+转化为Mg(OH)2
B.与Mg同周期的金属都可以采用电解熔融的无水氯化物来制备
C.试剂②可以选用盐酸
D.工业上也可以将Mg(OH)2煅烧分解为MgO,通过电解熔融MgO制取Mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有物质的量浓度均为0.1molL-1的①NH4Cl溶液,②NaCl溶液,③HCl溶液各20mL,下列说法错误的是( )
A.三种溶液中c(Cl-)的关系是①=②=③
B.若将三种溶液稀释相同的倍数,pH变化最小的是②
C.三种溶液中由水电离出的c(H+)的关系是①<②<③
D.若向三种溶液中分别加入20mL0.1molL-1的NaOH溶液后,pH最小的是③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )
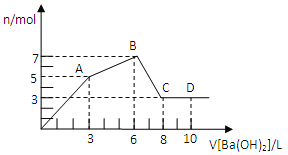
A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com