
【题目】汽车尾气脱硝脱碳主要原理为: ![]()
![]()
![]() 。一定条件下密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
。一定条件下密闭容器中,用传感器测得该反应在不同时间NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
|
|
|
|
|
|
|
|
|
|
|
|
完成下列填空:
(1)写出该反应的平衡常数表达式:__________________。
(2)前2s内的氮气的平均反应速率是: ![]() =___________
=___________ ![]() ;
;
达到平衡时,CO的转化率为_______________。
(3)工业上常采用“低温臭氧氧化脱硫脱硝”技术来同时吸收![]() 和氮的氧化物气体(
和氮的氧化物气体(![]() ),以获得
),以获得![]() 的稀溶液。在此溶液中,水的电离程度是受到了_________(填“促进”、“抑制”或“没有影响”);若往
的稀溶液。在此溶液中,水的电离程度是受到了_________(填“促进”、“抑制”或“没有影响”);若往![]() 溶液中再加入少量稀盐酸,则
溶液中再加入少量稀盐酸,则![]() 值将__________(填“变大”、“变小”或“不变”)。
值将__________(填“变大”、“变小”或“不变”)。
(4)如果向![]() 溶液中通入足量
溶液中通入足量![]() 气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象。_________________________。
气体,没有沉淀生成,继续滴加一定量的氨水后,则会生成白色沉淀。用平衡移动原理解释上述现象。_________________________。
(5)向另一种可溶性钡盐溶液中通入少量![]() 气体,会立即看到白色沉淀,该沉淀的化学式为_________;原可溶性钡盐可能是_________________。
气体,会立即看到白色沉淀,该沉淀的化学式为_________;原可溶性钡盐可能是_________________。
【答案】 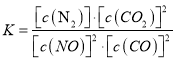 变小 1.75×10-3 0.89 促进 变大 饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生 BaSO4、Ba(NO3)2
变小 1.75×10-3 0.89 促进 变大 饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀;加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生 BaSO4、Ba(NO3)2
【解析】(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,所以K=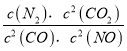 ,故答案为:K=
,故答案为:K=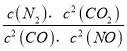 ;
;
(2)v(NO)= ![]() =3.5×10-3mol/(Ls),再根据反应速率与计量数关系得υ(N2)=1.75×10-3mol/(Ls);CO转化率=
=3.5×10-3mol/(Ls),再根据反应速率与计量数关系得υ(N2)=1.75×10-3mol/(Ls);CO转化率=![]() ×100%=
×100%=![]() ×100%=89%,故答案为:1.75×10-3;89%;
×100%=89%,故答案为:1.75×10-3;89%;
(3)(NH4)2SO4溶液存在铵根的水解平衡,促进水的电离;在(NH4)2SO4溶液中存在水解反应,2NH4++H2ONH3H2O+H+,往(NH4)2SO4溶液中加入少量稀盐酸,水解平衡向逆方向进行,的水解率减小,物质的量增大,而硫酸根离子的物质的量不变,所以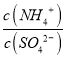 将变大,故答案为:促进;变大;
将变大,故答案为:促进;变大;
(4)因为饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生,故答案为:饱和SO2溶液中电离产生的SO32-很少,因此没有沉淀,而加入氨水后,促进H2SO3的电离,SO32-离子浓度增大,有沉淀产生;
(5)向硝酸钡溶液中通入少量![]() 气体,溶液显酸性,二氧化硫被硝酸氧化生成硫酸,会立即看到白色沉淀硫酸钡,故答案为:BaSO4;Ba(NO3)2。
气体,溶液显酸性,二氧化硫被硝酸氧化生成硫酸,会立即看到白色沉淀硫酸钡,故答案为:BaSO4;Ba(NO3)2。


科目:高中化学 来源: 题型:
【题目】下列离子在溶液中能大量共存的是( )
A. Na+、CO32-、SO42-、H+ B. K+、AlO2-、H+、Cl-
C. Fe2+、K+、OH-、NO3- D. Al3+、H+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。

(1)酸浸时发生的反应的离子方程式为__________________;
(2)配制TiCl4溶液时通常将TiCl4固体溶于浓盐酸再加水稀释,其目的是_________________________;
(3)加入H2C2O4溶液时,发生反应的化学方程式为____________________;可循环使用的物质X是________(填化学式),设计实验方案验证草酸氧钛钡晶体是否洗涤干净:_______________________;
(4)煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成高温下的气体产物有CO、_______和_________;
(5)工业上用饱和Na2CO3溶液处理重晶石(主要成分是BaSO4),待达到平衡后,移走上层清液,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。已知常温下:Ksp(BaSO4)=1.0×10-10,Ksp(BaCO3)=2.58×10-9,请问至少需要______ mol·L-1的碳酸钠溶液浸泡才能实现上述转化(忽略CO32-的水解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M被广泛用于医药、香料的合成,其一种合成路线如下(反应试剂与反应条件已省略):

已知A与B互为同分异构体。完成下列填空:
(1)写出M中含氧官能团的名称:__________。1mol D最多能与___________mol ![]() 发生加成反应。
发生加成反应。
(2)反应②所需试剂与条件是______________。反应③的反应类型是__________________。
(3)写出结构简式。A ___________________C _______________________
(4)写出检验D已完全转化为M的方法。___________________。
(5)写出两种符合下列要求的M的同分异构体的结构简式。 _____________
i. 苯环上的一氯代物只有两种 ii. 能发生水解反应 iii. 分子中含有两个甲基
(6)有人认为仅用反应①就能得到B,但事实证明产物中B的含量远远小于A,由此可以得到的结论是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积均为1L的三个密闭容器中,分别放入铁粉并充入1mo1CO ,控制在不同温度下发生反应:![]() 当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
当反应进行到5min时,测得CO的体积分数与温度的关系如图所示。下列说法一定正确的是
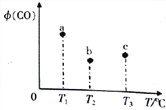
A. 反应进行到5min时,b容器中v(正)=v(逆)
B. 正反应为吸热反应,平衡常数:K(T1)>K(T2)
C. b中v(正)大于a中v(逆)
D. 达到平衡时,a、b、c中CO的转化率为b>c>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液呈无色,则下列关于溶液组成的判断正确的是( )。
①肯定不含I-;②肯定不含Cu2+;③肯定含有SO32-;④可能含有I-
A.①③ B.①②③ C.①③④ D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物(NOx)、SO2和CO2等气体会造成环境问题。对燃煤废气进行化学方法处理,可实现绿色环保、节能减排、废物利用等目的。
(1)利用甲烷催化还原NOx:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1=-572 kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160 kJ·mol-1
写出甲烷将NO2还原为N2并生成气态水时的热化学方程式________。
(2)工业上利用CO2生成甲醇燃料,反应为:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1
将6 mol CO2和8 mol H2充入容器为2 L的密闭容器中,恒温下,H2的物质的量随时间变化如图1实线所示(图中字母后的数字表示对应坐标)。
①该反应在0 min~8 min内CO2的平均反应速率为________。

②仅改变某一条件再进行实验,测得H2物质的量变化如图1虚线所示。与实线相比,曲线Ⅰ改变的条件可能是________,曲线Ⅱ改变的条件可能是________。
(3)反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH=-129.0 kJ/mol可用于合成甲醇。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是________(填字母)
CH3OH(g) ΔH=-129.0 kJ/mol可用于合成甲醇。按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图2所示。下列说法正确的是________(填字母)
A.温度:T1>T2>T3
B.正反应速率:ν(a)>ν(c)、 ν(b)>ν(d)
C.平衡常数:K(a)>K(c)、 K(b)=K(d)
D.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
(4)常温下,Ksp(BaCO3)=2.5×10-9,Ksp(BaSO4)=1.0×10-10,控制条件可实现如下沉淀转换:BaSO4(s)+CO32-(aq)![]() BaCO3(s)+SO42-(aq)该反应平衡常数K的表达式为:K=________,欲用1 L Na2CO3溶液将0.01 mol BaSO4全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于________。
BaCO3(s)+SO42-(aq)该反应平衡常数K的表达式为:K=________,欲用1 L Na2CO3溶液将0.01 mol BaSO4全部转化为BaCO3,则Na2CO3溶液的最初浓度应不低于________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com