
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.Z的最高价含氧酸的酸性弱于W的最高价含氧酸的酸性
D.原子半径的大小顺序:rW>rZ>rY>rX
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:选择题
配制一定体积、一定物质的量浓度的溶液,实验结果产生偏高影响的是
A.容量瓶中原有少量蒸馏水 B.溶解所用的烧杯未洗涤
C.称量时左码右物 D.定容时俯视观察液面
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二上学期期中测试化学试卷(解析版) 题型:填空题
(10分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
已知该反应在不同温度下的平衡常数如下:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 4.0 | 3.7 | 3.5 |
(1)该反应的平衡常数表达式K=________ ,ΔH________0(填“>”、“<”或“=”);
(2)在一个容积为5L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,此时比较v(正) v(逆) (填“>” “=” “<”),反应经过2min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________ ,CO的平衡转化率=________ ;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是________。
A、减少Fe的量 B、增加Fe2O3的量 C、移出部分CO2
D、提高反应温度 E、减小容器的容积 F、加入合适的催化剂
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:填空题
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010 mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)=0.010 mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是 (填写序号);
A.v逆(A)=2v正(B) B.容器内压强保持不变
C.v(C)=2v(B) D.容器内气体的密度保持不变
(2)若在相同的容器中加入0.100 mol A和0.050molB,500℃时充分反应达平衡后,放出热量Q2kJ,则2Q1 Q2(填“>”、“<”或“=”);
(3)500℃时,上述反应的化学平衡常数K= ;
(4)已知:K(300℃)<K(350℃),该反应是 (填“放热”或“吸热”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
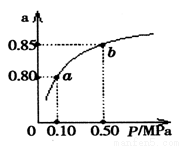
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省淄博市高二上学期期中测试化学试卷(解析版) 题型:选择题
已知:Na2O2(s)+CO2(g) Na2CO3(s) +
Na2CO3(s) +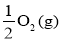 ΔH=-226 kJ/mol
ΔH=-226 kJ/mol
2CO(g)+O2(g) 2CO2(g) ΔH=-566 kJ/mol
2CO2(g) ΔH=-566 kJ/mol

 根据以上热化学方程式判断,下列说法正确的是
根据以上热化学方程式判断,下列说法正确的是
 A.CO的燃烧热为283 kJ
A.CO的燃烧热为283 kJ
B.2Na2O2(s)+2CO2(g) =2Na2CO3(s)+O2(g) ΔH=+452 kJ/mol
C.右图可表示由CO生成CO2的反应过程和能量关系
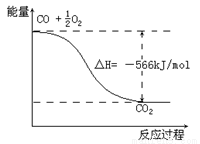
D.CO(g)与Na2O2(s)反应生成1molNa2CO3(s)时放出509kJ的热量
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:选择题
化学与人类生活、社会可持续发展密切相关。下列说法不正确的是
A.采用纳米TiO2光触媒技术,将装修材料中释放的HCHO转化为无害物质
B.CO2的水溶液呈酸性,CO2的大量排放会导致酸雨的形成
C.开发新能源,减少对化石燃料的依赖,可以促进低碳经济
D.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO4-+C2O42-+H+ CO2↑+Mn2++___。关于此反应的叙述正确的是
CO2↑+Mn2++___。关于此反应的叙述正确的是
A.该反应右边方框内的产物是OH-
B.配平该反应后,H+的化学计量数是8
C.该反应中氧化产物是CO2
D.该反应电子转移总数是5e-
查看答案和解析>>
科目:高中化学 来源:2016届湖北省襄阳市高三上学期期中测试化学试卷(解析版) 题型:选择题
工业上常用还原沉淀法处理含铬废水(Cr2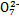 和Cr
和Cr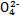 ),其流为:
),其流为:
Cr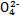
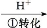 Cr2
Cr2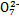
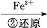 Cr3+
Cr3+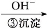 Cr(OH)3↓
Cr(OH)3↓
已知:
(1)步骤①中存在平衡:2Cr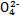 (黄色)+2H+
(黄色)+2H+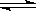 Cr2
Cr2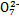 (橙色)+H2O
(橙色)+H2O
(2)步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s) 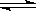 Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
(3)常温下,Cr(OH)3的溶度积Ksp=10-32;且当溶液中离子浓度小于10-5 mol·L-1时可视作该离子不存在
下列有关说法中正确的是
A.步骤①中加酸,将溶液的pH调节至2,溶液显黄色,Cr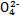 浓度增大
浓度增大
B.步骤①中当2v(Cr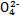 )=v(Cr2
)=v(Cr2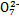 )时,说明反应2Cr
)时,说明反应2Cr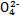 (黄色)+2H+
(黄色)+2H+  Cr2
Cr2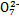 (橙色)+H2O达到平衡状态
(橙色)+H2O达到平衡状态
C.步骤②中,若要还原1 mol Cr2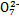 ,需要12 mol (NH4)2Fe(SO4)2·6H2O
,需要12 mol (NH4)2Fe(SO4)2·6H2O
D.步骤③中,当将溶液的pH调节至6时,则可认为废水中的铬已除尽
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三上学期10月教学质检理综化学试卷(解析版) 题型:推断题
A、B、C、D、E、X是中学常见的无机物,存在如下图转化关系(部分生成物和反应条件略去)。
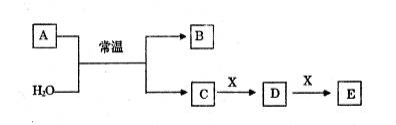
(1)若A为常见的金属单质,焰色反应呈黄色,X能使品红溶液褪色,写出C和E反应的离子方程式:_______________________。
(2)若A为短周期元素组成的单质,该元素的最高价氧化物的水化物酸性最强,则:
①组成单质A的元素在周期表中的位置为______________________。
②X可能为__________________(填代号)。
a.NaHCO3 b.Na2CO3 c.Na2SO3 d.Al(OH)3
(3)若A为淡黄色粉末,回答下列问题:
①A与H2O反应的氧化产物为_____________。
②若X为非金属单质,通常为黑色粉末,写出E的化学式______________。
③若X为一种造成温室效应的气体。则鉴别等浓度的D、E两种溶液,可选择的试剂为___________(填代号)。
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Ca(OH)2溶液
(4)若A为氧化物,X是Fe,溶液D中加入KSCN溶液变红。
①A与H2O反应的化学反应方程式为____________________________。
②检验溶液D中还可能存在Fe2+的方法是____________________________(注明试剂、现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com