
用草酸的稀溶液或草酸钠的酸性溶液可以洗涤粘在皮肤上的高锰酸钾,其离子方程式为(未配平):MnO4-+C2O42-+H+ CO2↑+Mn2++___。关于此反应的叙述正确的是
CO2↑+Mn2++___。关于此反应的叙述正确的是
A.该反应右边方框内的产物是OH-
B.配平该反应后,H+的化学计量数是8
C.该反应中氧化产物是CO2
D.该反应电子转移总数是5e-
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源:2015-2016学年江苏省无锡市四校高一上学期期中测试化学试卷(解析版) 题型:选择题
下列化学用语的表达正确的是
A.Na2SO4电离:Na2SO4=Na2++SO42-
B.Cl-的结构示意图:
C.质子数为6,中子数为8的微粒: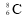
D.医用“钡餐”的化学式:BaSO4
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高一上学期期中测试化学试卷(解析版) 题型:选择题
下列实验操作中错误的是
A.蒸发操作时,当有较多固体析出时即可停止加热,利用余热将剩余液体蒸干
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
查看答案和解析>>
科目:高中化学 来源:2016届广西省高三上学期期中测试化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大,元素X的原子半径最小,Y元素和X元素在一定条件下能形成YX,Z和W的原子序数相差8,W原子的电子总数是其电子层数的5倍。下列叙述正确的是
A.Y可用于制造高性能可充电电池
B.WX3的沸点高于ZX3
C.Z的最高价含氧酸的酸性弱于W的最高价含氧酸的酸性
D.原子半径的大小顺序:rW>rZ>rY>rX
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三上学期第三次月考化学试卷(解析版) 题型:填空题
氮化硅硬度大、熔点高、不溶于酸(氢氟酸除外),是一种重要的结构陶瓷材料。一种用工业硅(含少量钾、钠、铁、铜的氧化物),已知硅的熔点是1420℃,高温下氧气及水蒸气能明显腐蚀氮化硅。一种合成氮化硅的工艺主要流程如下:
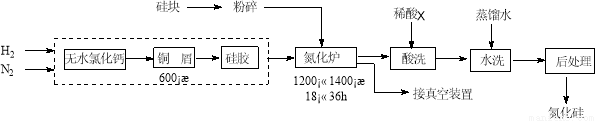
(1)净化N2和H2时,铜屑的作用是:_________________;硅胶的作用是 。
(2)在氮化炉中3Si(s)+2N2(g)=Si3N4(s) △H=-727.5kJ/mol,开始时为什么要严格控制氮气的流速以控制温度: ;
(3)X可能是 (选填:“盐酸”、“硝酸”、“硫酸”、“氢氟酸”)
(4)如何说明氮化硅产品已用水洗干净? 。
(5)用硅粉作硅源、叠氮化钠(NaN3)作氮源,直接燃烧生成氮化硅(发生置换反应),该反应的化学方程式为: 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省厦门市高三上学期期中测试化学试卷(解析版) 题型:选择题
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH+、Ca2+、Ba2+、Cl-、CO32―、SO42―,现取三份100 mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加入足量NaOH溶液加热后,收集到气体0.04 mol。
(3)第三份加入足量BaCl2溶液后,得沉淀6.27 g,经足量盐酸洗涤后,剩余沉淀质量为2.33 g。
根据上述实验,以下推测正确的是
A.K+一定存在,且c(K+)≥0.2mol·L―1
B.100 mL溶液中含CO32― 0.01mol
C.K+不一定存在
D.Cl― 一定存在
查看答案和解析>>
科目:高中化学 来源:2016届甘肃省天水市高三上学期第三次测试化学试卷(解析版) 题型:选择题
由铝屑、盐酸、氢氧化钠溶液反应制取1mol Al(OH)3,至少需要消耗HCl和NaOH的物质的量为
A.0.25mol,0.25mol B.0.75mol,0.75mol
C.1mol,1mol D.3mol,3mol
查看答案和解析>>
科目:高中化学 来源:2016届江苏省盐城市高三上学期期中测试化学试卷(解析版) 题型:填空题
硫-氨热化学循环制氢示意图如下:
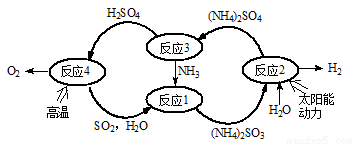
(1)反应1的离子方程式为 。
(2)反应2能量转化主要方式为 。
(3)反应3中控制反应条件很重要,不同条件下硫酸铵分解产物不同。若在400℃时分解,产物除水蒸气外还有A、B、C三种气体,A是空气中含量最多的单质,B能使湿润的红色石蕊试纸变蓝,C能使品红溶液褪色。则400℃时硫酸铵分解的化学方程式为 。
(4)反应4是由(a)、(b)两步反应组成:
H2SO4(l) =SO3(g) +H2O(g),△H=+177kJ•mol-1 …………(a)
2SO3(g)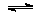 2SO2(g) + O2(g),△H=+196 kJ•mol-1…………(b)
2SO2(g) + O2(g),△H=+196 kJ•mol-1…………(b)
①则H2SO4(l)分解为SO2(g)、O2(g)及H2O(g)的热化学方程式为: 。
②在恒温密闭容器中,控制不同温度进行SO3分解实验。以SO3起始浓度均为cmol·L-1,测定SO3的转化率,结果如右图,图中Ⅰ曲线为SO3的平衡转化率与温度的关系,Ⅱ曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率。
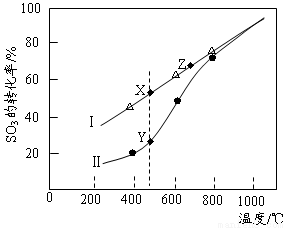
i)图中点X与点Z的平衡常数K:K(X) K(Z)(选填:>,<,=);
ii)Y点对应温度下的反应速率:v(正) v(逆)(选填:>,<,=);
iii)随温度的升高,Ⅱ曲线逼近Ⅰ曲线的原因是: 。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列有关电解质的叙述中错误的是
A.强电解质在水溶液里或熔融状态时的电离方式是一样的
B.弱电解质溶液可能比强电解质溶液的导电性强
C.HCl是强电解质,它只能在水溶液里才能电离
D.电解质溶液导电过程中必然伴随化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com