
| A. | 周期表中的各个主族都有非金属元素 | |
| B. | 周期表中的各个主族都有金属元素 | |
| C. | 周期表中的非金属元素都位于主族(除稀有气体) | |
| D. | 周期表中的非金属元素都位于短周期内 |
分析 A.第ⅡA族均为金属元素;
B.ⅤⅡ族均为卤素单质;
C.周期表中的非金属元素分别在ⅠA(H)及ⅢA、ⅣA、ⅤA、ⅥA、ⅤⅡA和零族;
D.长周期存在非金属元素,如Br、I等.
解答 解:A.第ⅡA族均为金属元素,则不符合各个主族都有非金属元素,故A错误;
B.ⅤⅡ族均为卤素单质,均为非金属单质,则不符合各个主族都有金属元素,故B错误;
C.周期表中的非金属元素分别在ⅠA(H)及ⅢA、ⅣA、ⅤA、ⅥA、ⅤⅡA和零族,则周期表中的非金属元素都位于主族(除稀有气体),故C正确;
D.长周期存在非金属元素,如Br、I等,则非金属元素可位于短周期或长周期内,故D错误;
故选C.
点评 本题考查元素周期表的结构及应用,为高频考点,把握元素的位置、元素在周期表的排布为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
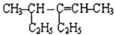 4-甲基-3-乙基-2-己烯
4-甲基-3-乙基-2-己烯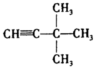 3,3-二甲基-1-丁炔.
3,3-二甲基-1-丁炔.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e-=Cu2+ | |
| B. | 由Al、Mg、NaOH组成的原电池,其负极反应式为:Al-3e-+3OH-=Al(OH)3↓ | |
| C. | 由Al、Mg、稀硫酸组成的原电池,其负极反应式为:Al-3e-=Al3+ | |
| D. | 由Fe、Cu、FeCl3组成的原电池,其正极反应式为:Cu-2e-=Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数依次增加.其中A元素原子的1s轨道上只有1个电子,B元素原子核外有三个未成对电子,B与C可形成离子化合物C3B2;D元素是地壳中含量最高的金属元素; E元素原子核外最外层只有1个电子,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
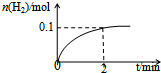 化学平衡:
化学平衡:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. .
. +Br2→
+Br2→ .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com