
| A、NaHCO3═Na++H++CO32- |
| B、KClO3═K++Cl-+3O2- |
| C、NaHSO4═Na++H++SO42- |
| D、NH3?H2O═NH4++OH- |


科目:高中化学 来源: 题型:
| A、Cu+2AgNO3═Cu(NO3)2+2Ag |
| B、2Fe+O2+2H2O═2Fe(OH)2 |
| C、NaOH+HCl═NaCl+H2O |
| D、2H2+O2═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A原子得到电子的数目比B原子少 |
| B、A元素的最高正价比B元素的最高正价要高 |
| C、气态氢化物的稳定性:A比B弱 |
| D、A单质能与B的氢化物水溶液反应,生成B单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、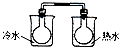 NO2球浸在冷水和热水中 | ||||||||
B、
| ||||||||
C、 | ||||||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①和② | B、①和④ |
| C、除了③ | D、除了③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、产物B的状态可能为气态、固态或液态 |
| B、平衡时,单位时间内m(A)消耗﹕m(C)消耗=1﹕1 |
| C、保持体积不变,向平衡体系中加入B,平衡可能不移动 |
| D、若开始时向容器中加入1molB和1molC,达到平衡时放出热量QKJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com