
| A、1:3 | B、2:3 |
| C、1:1 | D、4:3 |
| 36g-28g |
| 16g/mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
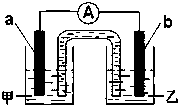 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu═2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-═Cu2+,还原反应式:2Fe3++2e-=2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将40 g NaOH溶解在1 L水中 |
| B、将22.4 L HCl气体溶于水配成1 L溶液 |
| C、将1 L 10 mol/L浓盐酸加入9 L水中 |
| D、将10 g NaOH溶解在少量水中,再加蒸馏水直到溶液体积为250 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol钠与O2反应生成Na2O 或Na2O2,转移的电子数目均为2NA |
| B、1molO2和足量的Mg或Al完全反应,电子转移数目之比为2:3 |
| C、Na、Mg、Al各1mol和足量的O2反应,电子转移数目之比为1:2:3 |
| D、Cu、Mg各1mol在O2中充分燃烧,电子转移数目之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2 |
| B、放电时每转移3 mol电子,正极有1mol K2FeO4被还原 |
| C、充电时阳极反应为:Fe(OH)3-3e-+5 OH-=FeO42-+4H2O |
| D、放电时正极附近溶液的碱性减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaHCO3═Na++H++CO32- |
| B、KClO3═K++Cl-+3O2- |
| C、NaHSO4═Na++H++SO42- |
| D、NH3?H2O═NH4++OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com