
〔化学—选修2:化学与技术〕(15分)
磷矿石主要以磷酸钙〔Ca3(PO4)2·H2O〕和磷灰石〔Ca3(OH)(PO4)3〕等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过各中由磷灰石制单质磷的流程。

部分物质的相关性质如下:
| | 熔点/℃ | 沸点/℃ | 备注 |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
(1)69; (2) Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;0.49;(3)CaSiO3;液态白磷;固态白磷;(4)SiF4、CO;SiF4、HF、 H2S ;PH3 (5)产品纯度大(浓度大)
解析试题分析:(1)根据图示可知生产含磷肥料,约占磷矿石使用量的比例是0.04+0.96×0.85×0.80="0.69." (2)以磷灰石为原料,用过量的硫酸溶解Ca3F(PO4)3,可制得磷酸。根据质量守恒定律可得反应的化学方程式为Ca3F(PO4)3+5H2SO4=3H3PO4+ 5CaSO4+HF↑;根据P守恒可得关系式 P2O5~2H3PO4.142份P2O52可制取196份的磷酸。1吨折合含有五氧化二磷约30%的磷灰石,含有P2O5的质量是0.3吨,所以可制取85℅的商品磷酸是质量是(196×0.3t)÷142÷0.85="0.49t;(3)" 二氧化硅、过量焦炭与磷灰石混合,在高温下反应除了得到白磷外,得到的难溶性的固体物质是CaSiO3;冷凝塔1的温度是70℃,280. 5℃>t>44℃所以此时主要沉积物是液态白磷;冷凝塔2的温度是12℃,低于白磷的熔点,故此时主要沉积物是固态白磷。(4)根据题目提供的信息,结合反应实际,在尾气中主要含有SiF4、CO,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液, SiF4、HF、 H2S会与碳酸钠反应而除去;再通入次氯酸钠溶液,由于次氯酸钠有强氧化性,因此可除去有还原性的PH3 。(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高。但是产品纯度大,杂质少,因此逐渐被采用。
考点:考查磷矿石的主要用途、反应原理及有关计算的知识。


科目:高中化学 来源: 题型:单选题
漂粉精常用于消毒游泳池中的水。有关漂粉精的叙述不正确的是
| A.生产原料是消石灰和氯气 | B.不宜长久储存 |
| C.有腐蚀及漂白作用 | D.消毒后无残渣,不会堵塞管道 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)A~H等8种物质存在如下转化关系(反应条件、部分产物未标出)。已知A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体。按要求回答问题: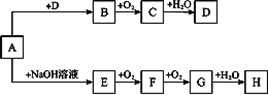
(1)写出下列物质的化学式:A ,B 。
(2)写出下列反应的化学方程式:E→F ;
写出下列反应的离子方程式:A→E ;
H的浓溶液与木炭反应的化学方程式: 。
(3)检验某溶液中是否含D中阴离子的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
海洋是一个丰富的资宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、蒸发池和 池。
②目前工业上采用比较先进的离子交换膜电解槽法进行氯碱工业生产,在电解槽中阳离子交换膜只允许阳离子通过,阻止阴离子和气体通过,请说明氯碱生产中阳离子交换膜的作用: (写一点即可)。
(2)电渗析法是近年发展起的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
①海水不能直接通入到阴极室中,理由是 。
②A口排出的是 (填“淡水”或“浓水”)。
(3)用苦卤(含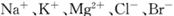 等离子)可提取溴,其生产流程如下:
等离子)可提取溴,其生产流程如下:
①若吸收塔中的溶液含BrO3-,则吸收塔中反应的离子方程式为: 。
②通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化重新获得含Br2的溶液? 。
③向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)(I) 海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘:
①在滤液中,滴加几滴硫酸和适量的双氧水 ②将海带烧成灰,向灰中加水,加热搅拌
③加CC14振荡、静置 ④过滤 ⑤分液。
(1)合理的操作顺序为 。
(2)步骤③中要用到的玻璃仪器为 ,该步分离I2的操作叫 。
(II)向某含有Fe2+、I—、Br—的溶液中缓缓通入适量氯气,溶液中各种离子的物质的量变化如图所示。
(3)AB段表示 离子的减少。
(4)n(Cl2)=2mol时,溶液中反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(7分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:__________________________________。
(2)在一定体积的18 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100mL。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为______________。
(3)根据下图操作及现象推断酸X为_______(填序号)。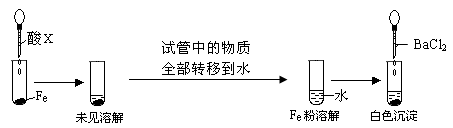
a.浓盐酸 b.浓硫酸 c.浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅是重要的半导体材料,构成了现代电子工业的基础。回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。
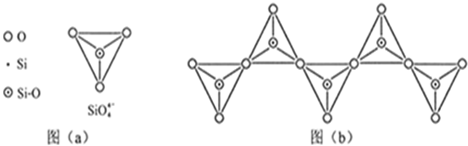
(2)硅主要以硅酸盐、 等化合物的形式存在于地壳中。
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以 相结合,其晶胞中共有8个原子,其中在面心位置贡献 个原子。
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备。工业上采用Mg2Si和NH4CI在液氨介质中反应制得SiH4,该反应的化学方程式为 。
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表是实验室制备气体的有关内容:
| 编号 | 实验内容 | 实验原理 | 气体发生装置 |
| ① | 制氧气 | H2O2―→O2 | |
| ② | 制氨气 | NH4Cl―→NH3 | |
| ③ | 是氯气 | HCl―→Cl2 | |


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com