
【题目】(普通)某烃A的相对分子质量为28,可以使溴的四氯化碳溶液褪色,F高分子化合物,它有如下转化关系:
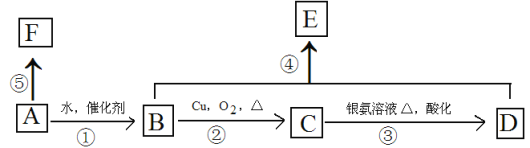
按要求填空:
(1)写出C中所含官能团的名称 ,指出④的反应类型 。
(2)若B转化为A,所需反应条件为: 。
(3)写出B和F结构简式:B ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出反应④对应的化学方程式: 。
(6)E的同分异构体有多种,其中能与NaHCO3反应的同分异构体共有 种
【答案】
(1)醛基;酯化反应或取代反应
(2)浓硫酸、170℃
(3)CH3CH2OH;![]()
(4)2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
(5)CH3COOH+HOC2H5![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
(6)2
【解析】
试题分析:烃A的相对分子质量为28,可以使溴的四氯化碳溶液褪色,则A为CH2=CH2,乙烯与水发生加成反应生成B为CH3CH2OH,乙醇发生催化氧化生成C为CH3CH2O,乙醛进一步发生氧化反应生成D为CH3COOH,乙酸与乙醇发生酯化反应生成E为CH3CH2OOCH2CH3,F高分子化合物,则乙烯发生加聚反应生成F为![]() 。
。
(1)C为CH3CH2O,C中所含官能团的名称醛基,④的反应类型为酯化反应或取代反应。
故答案为:醛基;酯化反应或取代反应;
(2)若B转化为A是乙醇发生消去反应生成乙烯,所需反应条件为:浓硫酸、170℃。
故答案为:浓硫酸、170℃;
(3)B的结构简式为CH3CH2OH,F的结构简式为![]() 。
。
故答案为:CH3CH2OH;![]() ;
;
(4)反应③乙醛被氧化生成乙酸,反应方程式为:2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
故答案为:2CH3CHO+O2![]() 2CH3COOH;
2CH3COOH;
(5)反应④乙酸与乙醇发生酯化反应生成乙酸乙酯,反应方程式为:CH3COOH+HOC2H5![]() CH3COOC2H5+H2O。
CH3COOC2H5+H2O。
故答案为:CH3COOH+HOC2H5![]() CH3COOC2H5+H2O;
CH3COOC2H5+H2O;
(6)E为CH3CH2OOCH2CH3的同分异构体能与NaHCO3反应,说明含有羧基,可以看作丙烷被-COOH取代,同分异构体的结构简式为:CH3CH2CH2COOH、(CH3)2CHCOOH。
故答案为:2。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 最外层都只有2个电子的X、Y原子,化学性质一定相似
B. 在所有的元素中,氟的电负性最大
C. 前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有4种
D. 次氯酸分子的电子式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镭是周期表中第7周期第ⅡA主族元素,下列关于镭的性质描述中不正确的是( )
A.在化合物中呈+2价
B.镭比钙的金属性强
C.氢氧化物呈两性
D.碳酸盐难溶于水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
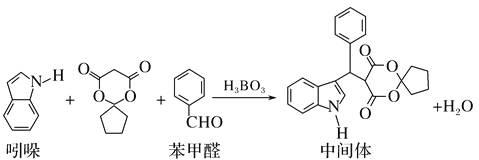
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1.5 mol氧气中含有的O2的个数为_____________,标准状况下体积为_________L,与_____________gH2O所含的原子总数相等。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,则NO和NO2的体积比为___________。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则A与B的密度之比为________,摩尔质量之比为_______。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,A的摩尔质量是______________。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在工农业生产及日常生活中有重要用途。请回答下列问题:
(1)Al原子的价电子排布图为_________________________________,Na、Mg、Al的第一电离能由小到大的顺序为________________________。
(2)某含有铝元素的翡翠的化学式为Be3Al2(Si6O18),其中Si原子的杂化轨道类型为________。
(3)工业上用氧化铝、氮气、碳单质在高温条件下可制备一种四面体结构单元的高温结构陶瓷,其晶胞如图所示:
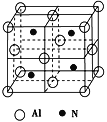
①该制备反应的化学方程式为___________________________________.
②该化合物的晶体类型为_______________,该晶胞中有____个铝原子,该晶胞的边长为a pm,则该晶胞的密度为____________g·cm-3。
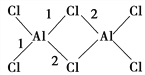
(4)AlCl3的相对分子质量为133.5,183 ℃开始升华,易溶于水、乙醚等,其二聚物(Al2Cl6)的结构如图所示,图中1键键长为206 pm,2键键长为221 pm,从键的形成角度分析1键和2键的区别:__________________________________________。
(5)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇:
CH3COOH ![]() CH3CH2OH
CH3CH2OH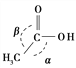
CH3COOH分子中π键和σ键的数目之比为________,分子中键角α________键角β(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2mol Sb (CH3)2Br和2 molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物[Sb2(CH3)5]2[Sb2(CH3)2Br6]。请回答:
(1)  中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
(2)[Sb2(CH3)5]+的结构式为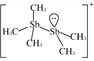 ,Sb原子的杂化轨道类型为_________。写出一种与CH
,Sb原子的杂化轨道类型为_________。写出一种与CH![]() 互为等电子体的阳离子_________。
互为等电子体的阳离子_________。
(3)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2![]() I
I![]() 。I
。I![]() 离子的空间构型为__________。
离子的空间构型为__________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a)[SbCl![]() ][GaCl
][GaCl![]() ]或(b)[GaCl
]或(b)[GaCl![]() ][SbCl
][SbCl![]() ],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
(5)固态PCl5结构中存在PCl![]() 和PCl
和PCl![]() 两种离子,其晶胞如图所示。
两种离子,其晶胞如图所示。
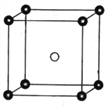
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl![]() 和PCl
和PCl![]() 之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A.大力发展火力发电,解决电力紧张问题
B.在屋顶安装太阳能热水器为居民提供生活用热水
C.用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D.用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com