
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2mol Sb (CH3)2Br和2 molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物[Sb2(CH3)5]2[Sb2(CH3)2Br6]。请回答:
(1)  中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
(2)[Sb2(CH3)5]+的结构式为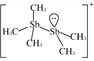 ,Sb原子的杂化轨道类型为_________。写出一种与CH
,Sb原子的杂化轨道类型为_________。写出一种与CH![]() 互为等电子体的阳离子_________。
互为等电子体的阳离子_________。
(3)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2![]() I
I![]() 。I
。I![]() 离子的空间构型为__________。
离子的空间构型为__________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a)[SbCl![]() ][GaCl
][GaCl![]() ]或(b)[GaCl
]或(b)[GaCl![]() ][SbCl
][SbCl![]() ],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
(5)固态PCl5结构中存在PCl![]() 和PCl
和PCl![]() 两种离子,其晶胞如图所示。
两种离子,其晶胞如图所示。
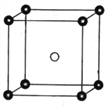
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl![]() 和PCl
和PCl![]() 之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
【答案】 Br>C>H 3s23p63d10 sp3杂化 H3O+ 直线形 a GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—] ![]() a×103
a×103 ![]()
【解析】(1)元素的非金属性越强,电负性数值越大,H、C、Br的电负性由大到小的顺序为Br>C>H;溴原子的M能层排满了电子,电子排布式为3s23p63d10,故答案为:Br>C>H;3s23p63d10;
(2)根据[Sb2(CH3)5]+的结构式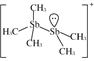 可知,Sb原子的价层电子对数均=4,采用sp3杂化;与CH3-互为等电子体的阳离子为H3O+,故答案为:sp3杂化;H3O+;
可知,Sb原子的价层电子对数均=4,采用sp3杂化;与CH3-互为等电子体的阳离子为H3O+,故答案为:sp3杂化;H3O+;
(3)I3-离子的中心原子I的价层电子对数=2+![]() (7+1-1×2)=5,根据价层电子对互斥理论知,该微粒价层电子对个数是5且含有3个孤电子对,所以其空间构型为直线形,故答案为:直线形;
(7+1-1×2)=5,根据价层电子对互斥理论知,该微粒价层电子对个数是5且含有3个孤电子对,所以其空间构型为直线形,故答案为:直线形;
(4)[SbCl2+]中Sb的价层电子对数=2+![]() (5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+
(5-1+2×1)=3,[GaCl2+]中Ga的价层电子对数=2+![]() (3-1+2×1)=2;[SbCl2+][GaCl4-]中阳离子Sb呈+3价属合N族元素价键规律,阴离子Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价属合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:a;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(3-1+2×1)=2;[SbCl2+][GaCl4-]中阳离子Sb呈+3价属合N族元素价键规律,阴离子Ga有三个电子与三个Cl原子形成三个共用电子对后还有一个空P轨道,可以结合一个氯离子形成8电子稳定结构;[GaCl2+][SbCl4-]中阳离子镓呈正三价属合第IIIA族元素价键规律,但是阴离子中Sb原子周围却有9个电子,比8电子稳定结构多一个电子,故不稳定,因此结构应是[SbCl2+][GaCl4-],故答案为:a;GaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—];
(5)根据图示,则PCl4+和PCl6-之间的最短距离为体对角线长度的一半=![]() a×103 pm;
a×103 pm;
由晶胞结构可知,PCl4+和PCl6-的数目分别为8×![]() =1和1,则晶胞质量为
=1和1,则晶胞质量为![]() g,晶胞边长为a nm,则晶胞密度
g,晶胞边长为a nm,则晶胞密度![]() g÷(a×10-7cm)3=
g÷(a×10-7cm)3=![]() g/cm3,故答案为:
g/cm3,故答案为: ![]() a×103;
a×103; ![]()


科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)乙醇是一种重要的燃料,工业上利用乙烯制酒精:C2H4(g)+H2O(l)=C2H5OH(l) ΔH,已知乙烯、乙醇的燃烧热分别是1411.0kJ·mol-1、1366.8 kJ·mol-1,则ΔH=_____________。
(2)用Cu2Al2O4作催化剂,一定条件下发生反应:CO2(g)+CH4(g)![]() CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
CH3COOH(g),温度与催化剂的催化效率和乙酸的生成速率的关系如图,回答下列问题:
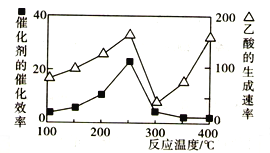
①200~250℃时,乙酸的生成速率升高的主要原因是____________________________。
②300~400℃时,乙酸的生成速率升高的主要原因是____________________________。
(3)甲醇作为一种重要的化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为CH3OH(g)+CO(g)![]() HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ/mol。向体积为1L的密闭容器中充入3mol CH3OH(g)和3mol CO(g),测得容器内的压强(p: kPa) 随时间(t: min) 的变化关系如图中Ⅰ、Ⅱ、Ⅲ曲线所示:
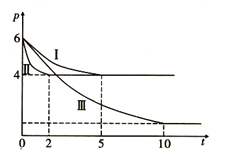
①Ⅱ和Ⅰ相比,Ⅱ中改变的反应条件是_______________________。
②Ⅲ和Ⅰ相比,Ⅲ中改变的反应条件是_________________,判断的理由是________________________。
③反应Ⅰ在5min 时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)= ________________。
④反应Ⅱ在2min 时达到平衡,平衡常数K(Ⅱ)= ______________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入2mol CH3OH 和1mol HCOOCH3后,平衡_______移动(填“正向”“逆向”或“不”),原因是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(普通)某烃A的相对分子质量为28,可以使溴的四氯化碳溶液褪色,F高分子化合物,它有如下转化关系:
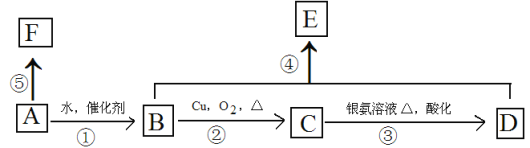
按要求填空:
(1)写出C中所含官能团的名称 ,指出④的反应类型 。
(2)若B转化为A,所需反应条件为: 。
(3)写出B和F结构简式:B ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出反应④对应的化学方程式: 。
(6)E的同分异构体有多种,其中能与NaHCO3反应的同分异构体共有 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A. 等于0.3 mol B. 小于0.3 mol
C. 大于0.3 mol D. 以上结论都不正确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:
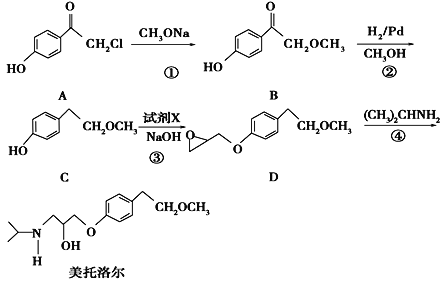
请回答下列问题:
(1)写出C中的官能团的名称为_________________.
(2)美托洛尔的分子式________________.
(3)写出反应①的化学方程式__________________________________________;反应②的反应类型是_____________
(4)反应③中加入的试剂X的分子式为C3H5OCl,X的结构简式为____________________.
(5)满足下列条件的B的同分异构体有有_______种,其中核磁共振氢谱有六种不同化学环境的氢,且峰面积比为3∶2∶2∶1∶1∶1的是________________________(写结构简式)
①能发生银镜反应而且能发生水解
②能与FeCl3溶液发生显色反应
③只有一个甲基
(6)根据已有知识并结合题目所给相关信息,写出以![]() 和
和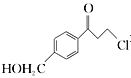 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]() _______________________
_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据各概念图作出的判断,不正确的是
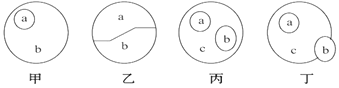
A. 甲图中a和b可以表示核糖和单糖的关系
B. 若乙中a和b分别代表DNA和RNA,则乙图可以代表原核细胞内的核酸
C. 丙图中a、b、c可分別表示磷脂、固醇和脂质之间的关系
D. 丁图a、b、c可分别表示激素、酶和蛋白质之间的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W五种短周期元素。X原子的质子数与电子层数相同,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示。下列说法不正确的是
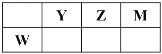
A. 原子半径:W>Y>Z>M>X
B. 热稳定性:XM>X2Z
C. 仅由X、Y、Z三种元素形成的化合物中不可能含离子键
D. WM4分子中每个原子最外层均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关分子结构 ![]() 的下列叙述中,正确的是
的下列叙述中,正确的是
A.可能在同一平面上的原子最多有20个
B.12个碳原子不可能都在同一平面上
C.所有的原子都在同一平面上
D.除苯环外的其余碳原子有可能都在一条直线上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com