
【题目】将0.2 mol MnO2和50 mL 12 mol/L盐酸混合后缓缓加热,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量为(不考虑盐酸的挥发)
A. 等于0.3 mol B. 小于0.3 mol
C. 大于0.3 mol D. 以上结论都不正确
【答案】C
【解析】
MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,以此解答该题。
反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol;根据方程式可以知道0.2 mol MnO2反应需要HCl为0.2×4=0.8mol>0.6mol ,故MnO2过量,如盐酸完全反应,则生成氯气为0.6mol×1/4=0.15mol,溶液剩余Cl-为0.6mol-0.15mol×2=0.3mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余 Cl-大于0.3 mol ;所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6 mol ;
MnCl2+Cl2↑+2H2O,n(MnO2)=0.2mol,n(HCl)=0.05L×12mol/L=0.6mol;根据方程式可以知道0.2 mol MnO2反应需要HCl为0.2×4=0.8mol>0.6mol ,故MnO2过量,如盐酸完全反应,则生成氯气为0.6mol×1/4=0.15mol,溶液剩余Cl-为0.6mol-0.15mol×2=0.3mol,但MnO2只与浓盐酸反应生成氯气和氯化锰,随着盐酸浓度的降低,HCl的还原性减弱,反应停止,所以溶液中溶液剩余 Cl-大于0.3 mol ;所以,反应完全后向留下的溶液中加入足量AgNO3溶液,生成AgCl沉淀物质的量大于0.3mol,小于0.6 mol ;
综上所述,本题选C。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】已知某粗盐样品含有Na2SO4、MgCl2、CaCl2等杂质。实验室提纯流程如下:
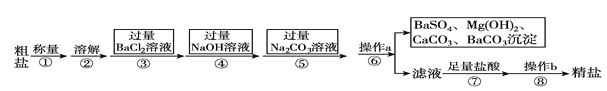
(1)操作a的名称为________,在操作b中玻璃棒的作用是_____________________。
(2)进行步骤③后,判断BaCl2过量的方法是______________________________(写出步骤、现象)。
(3)步骤⑦中能用稀硫酸代替稀盐酸吗?________(填“能”或“不能”),原因是_____________。
(4)某氯化钾样品中含杂质硫酸钾,为了除去硫酸钾,要做以下实验:
A.向滤液中滴加稀盐酸,边滴边振荡至不再产生气体
B.将氯化钾样品溶于适量蒸馏水,配成溶液
C.过滤,将白色沉淀滤出
D.向溶液中加入过量碳酸钾溶液,边滴边振荡至不再产生白色沉淀
E.向溶液中加入过量氯化钡溶液,边滴边振荡至不再产生沉淀
F.将滤液蒸干,得到晶体
①正确的实验操作顺序为______________(填写序号)。
②进行F操作时用到的仪器主要有____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某抗肿瘤药物中间体的合成路线如下。下列说法正确的是( )
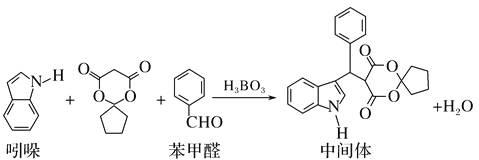
A. 吲哚的分子式为C8H6N
B. 苯甲醛中所有原子不可能全部共平面
C. 可用新制氢氧化铜悬浊液区分苯甲醛和中间体
D. 1mol该中间体,最多可以与9mol氢气发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在工农业生产及日常生活中有重要用途。请回答下列问题:
(1)Al原子的价电子排布图为_________________________________,Na、Mg、Al的第一电离能由小到大的顺序为________________________。
(2)某含有铝元素的翡翠的化学式为Be3Al2(Si6O18),其中Si原子的杂化轨道类型为________。
(3)工业上用氧化铝、氮气、碳单质在高温条件下可制备一种四面体结构单元的高温结构陶瓷,其晶胞如图所示:
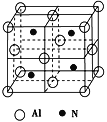
①该制备反应的化学方程式为___________________________________.
②该化合物的晶体类型为_______________,该晶胞中有____个铝原子,该晶胞的边长为a pm,则该晶胞的密度为____________g·cm-3。
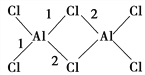
(4)AlCl3的相对分子质量为133.5,183 ℃开始升华,易溶于水、乙醚等,其二聚物(Al2Cl6)的结构如图所示,图中1键键长为206 pm,2键键长为221 pm,从键的形成角度分析1键和2键的区别:__________________________________________。
(5)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇:
CH3COOH ![]() CH3CH2OH
CH3CH2OH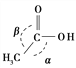
CH3COOH分子中π键和σ键的数目之比为________,分子中键角α________键角β(填“大于”、“等于”或“小于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾和浓盐酸可以发生下列反应:2KMnO4+16HCl(浓)===5Cl2↑+2MnCl2+2KCl+8H2O
(1)用双线桥法表示此反应的电子转移的方向及数目_____________
(2)该反应的氧化剂是______,还原剂是________。HCl表现 ___________性和 ____性。
(3)若消耗0.2 mol氧化剂,转移电子的物质的量是________ mol。生成氯气在标准状况下的体积是__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2mol Sb (CH3)2Br和2 molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物[Sb2(CH3)5]2[Sb2(CH3)2Br6]。请回答:
(1)  中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
中,H、C、Br的电负性由大到小的顺序为________,溴原子的M能层电子排布式为________。
(2)[Sb2(CH3)5]+的结构式为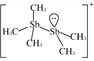 ,Sb原子的杂化轨道类型为_________。写出一种与CH
,Sb原子的杂化轨道类型为_________。写出一种与CH![]() 互为等电子体的阳离子_________。
互为等电子体的阳离子_________。
(3)碘在水中的溶解度虽然小,但在碘化钾溶液中溶解度却明显增大,这是由于发生I-+I2![]() I
I![]() 。I
。I![]() 离子的空间构型为__________。
离子的空间构型为__________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a)[SbCl![]() ][GaCl
][GaCl![]() ]或(b)[GaCl
]或(b)[GaCl![]() ][SbCl
][SbCl![]() ],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
],该离子化合物最可能的结构组成为________ (填“a”或“b”),理由是_____________________________。
(5)固态PCl5结构中存在PCl![]() 和PCl
和PCl![]() 两种离子,其晶胞如图所示。
两种离子,其晶胞如图所示。
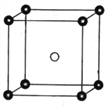
已知晶胞的边长为a nm,阿伏加德罗常数值用NA表示。则PCl![]() 和PCl
和PCl![]() 之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国北方的山岗荒坡间有一种草本植物,别名奈何草,其中含有抗菌作用的某有机物M的合成路线如下图所示:
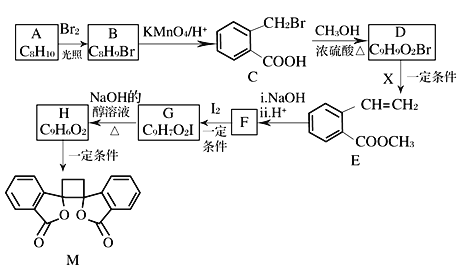
已知:ⅰ.RCH2Br![]() R—HC=CH—R'
R—HC=CH—R'
ⅱ.R—HC=CH—R' ![]()
![]()
ⅲ.R—HC=CH—R' ![]()
![]() (以上R、R'、R″代表氢、烷基或芳基等)
(以上R、R'、R″代表氢、烷基或芳基等)
(1)A的化学名称为_____,B的核磁共振氢谱显示为_____组峰。
(2)由C生成D的反应类型为_____。
(3)1 mol M与足量NaOH溶液反应,消耗_____mol NaOH。
(4)X的结构式为_____,F的结构简式为_____________。
(5)由G生成H的化学方程式为_______________________________。
(6)符合下列条件的E的同分异构体共_____种(不考虑立体异构)。
①芳香族化合物 ②与E具有相同官能团 ③能发生银镜反应 ④酸性条件下水解产物遇氯化铁溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.实验室用下图装置制取并研究SO2的性质。
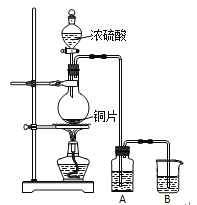
完成下列填空:
(1)圆底烧瓶中反应的化学方程式为_____________________________________。
(2)若A中盛放品红溶液,可以验证的SO2性质是______________。若要验证SO2的还原性,A中应盛放_________溶液。B中应盛放_________溶液。
II.为测定反应后的溶液中残留的硫酸浓度,实验小组进行如下探究。
(3)甲组:取1 mL反应液加水稀释至100 mL,再取10 mL稀释液与足量锌粒用下图装置进行测定。在读取反应前后量气管中液面读数时应先调节水准管与量气管中液面等高,这样操作的目的是________。
实验测得反应生成的氢气体积为22.4 mL(已换算到标准状况),计算原反应液中残留的硫酸浓度为______mol/L。

(4)乙组:欲通过加入足量的BaCl2溶液,测定生成的BaSO4沉淀质量来达到实验目的。该设计思路不可行,理由是_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com