
【题目】(1)1.5 mol氧气中含有的O2的个数为_____________,标准状况下体积为_________L,与_____________gH2O所含的原子总数相等。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,则NO和NO2的体积比为___________。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则A与B的密度之比为________,摩尔质量之比为_______。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,A的摩尔质量是______________。
(5)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是________。
【答案】9.03×1023 33.6 18 2:3 4:5 4:5 64g/mol 0.025mol
【解析】
(1)1.5 mol氧气中含有的O2个数为1.5mol×6.02×1023/mol=9.03×1023,标准状况下体积为1.5mol×22.4L/mol=33.6L。含有氧原子的物质的量是3mol,则与1molH2O所含的原子总数相等,质量是18g。
(2)在标准状况下,体积为6.72L的NO和NO2混合气,质量为11.88g,混合气体的物质的量是6.72L÷22.4L/mol=0.3mol,则混合气体的平均相对分子质量是11.88÷0.3=39.6,所以根据十字交叉法可知NO和NO2的体积比为![]() 。
。
(3)同温同压下,两种气体A和B的体积之比为2∶1,质量之比为8∶5,则根据![]() 可知A与B的密度之比为
可知A与B的密度之比为![]() 。根据阿伏加德罗定律可知相同条件下气体的摩尔质量之比等于密度之比,即为4:5。
。根据阿伏加德罗定律可知相同条件下气体的摩尔质量之比等于密度之比,即为4:5。
(4)某状况下,2g二氧化碳气体的体积是1120 mL,2gA气体的体积是770 mL,则根据阿伏加德罗定律可知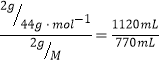 ,解得M=64g/mol,即A的摩尔质量是64g/mol。
,解得M=64g/mol,即A的摩尔质量是64g/mol。
(5)某硫酸钠溶液中含有3.01×1022个Na+,物质的量是0.05mol,则根据硫酸钠的化学式Na2SO4可知溶液中SO42-的物质的量是0.05mol÷2=0.025mol。


科目:高中化学 来源: 题型:
【题目】下列物质①NaHSO4 ②HCl ③Cu ④CO2 ⑤Ba(OH)2 ⑥ NaOH ⑦ NaHCO3 ⑧CH3COOH
(1)属于强电解质的是__________(填序号);水溶液能导电的是_______________(填序号)。
(2)写出下列物质在水溶液中的电离方程式
①:__________________________________________
⑦:__________________________________________
⑧:__________________________________________
(3)写出下列物质相互反应的离子方程式
少量的①与⑤:_______________________________________________。
⑥与⑧:_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(普通)某烃A的相对分子质量为28,可以使溴的四氯化碳溶液褪色,F高分子化合物,它有如下转化关系:
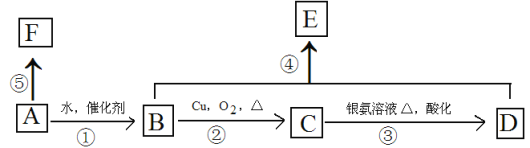
按要求填空:
(1)写出C中所含官能团的名称 ,指出④的反应类型 。
(2)若B转化为A,所需反应条件为: 。
(3)写出B和F结构简式:B ;F 。
(4)写出反应③对应的化学方程式: 。
(5)写出反应④对应的化学方程式: 。
(6)E的同分异构体有多种,其中能与NaHCO3反应的同分异构体共有 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Z由如下反应得到:C4H9Br![]() Y
Y![]() Z,Z的结构简式不可能是( )
Z,Z的结构简式不可能是( )
A.CH3CH2CHBrCH2Br
B.CH3CH(CH2Br)2
C.CH3CHBrCHBrCH3
D.CH2BrCBr(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔是一种治疗高血压的药物的中间体,可以通过以下方法合成:
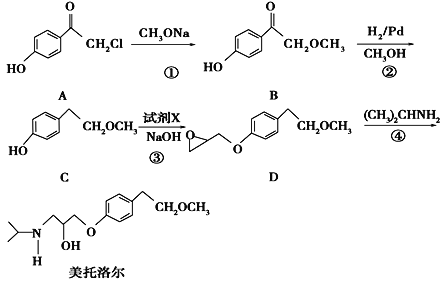
请回答下列问题:
(1)写出C中的官能团的名称为_________________.
(2)美托洛尔的分子式________________.
(3)写出反应①的化学方程式__________________________________________;反应②的反应类型是_____________
(4)反应③中加入的试剂X的分子式为C3H5OCl,X的结构简式为____________________.
(5)满足下列条件的B的同分异构体有有_______种,其中核磁共振氢谱有六种不同化学环境的氢,且峰面积比为3∶2∶2∶1∶1∶1的是________________________(写结构简式)
①能发生银镜反应而且能发生水解
②能与FeCl3溶液发生显色反应
③只有一个甲基
(6)根据已有知识并结合题目所给相关信息,写出以![]() 和
和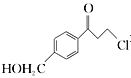 为原料制备
为原料制备![]() 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:![]() _______________________
_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】细菌冶金是近年来新兴的绿色冶金工艺,它主要是应用细菌法溶浸贫矿、废矿、尾矿和炉渣等,以回收某些贵重有色金属和稀有金属,节约矿产资源,最大限度地利用矿藏的一种冶金方法。其中细菌治铜的生产流程为:
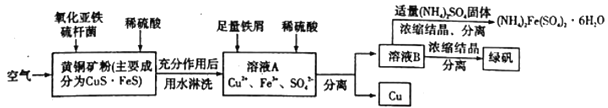
(1)上述生产流程中有三步用到了同一种分离方法,实验室中不能用这种分离方法来分离液态胶体中分散质的原因是______________________________。
(2)绿矾(FeSO4·7H2O)是一种良好的还原剂,也可用来制取治疗缺铁性贫血的药剂和食品调味剂。在保存绿矾时,必须_______________________。在溶液B中加入适量(NH4)2 (SO4)2固体,加热浓缩时,可以得 到(NH4)2Fe(SO4)4·6H2O的原因是________________________________________________。
(3)溶液B中一定含有的阳离子是________________。若在溶液A中加入少量铁屑只发生其中的一个反应,则此反应的平衡常数的表达式为_______________________________。
(4)写出黄铜矿中的CuS·FeS在氧化亚铁硫杆菌(Thiobacillus ferrooxidans,简写为T.f)作用下被空气氧化生成溶液A的离子方程式:___________________________________。
(5)氧化亚铜可用作船底防污漆,以杀死低级海生动物而保护船体,可用作陶瓷和搪瓷的着色剂和红色 玻璃的染色剂,氧化亚铜也是一种重要的半导体材料。请用浓的强碱溶液,根据2Cu+H2O![]() Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
Cu2O+H2↑反应,设计出工业生产氧化亚铜的一种方法:___________________________________ (只要求画实验装置图,,其它必要材料任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com