
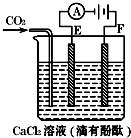
 如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.
如图为持续电解含一定CaCl2水溶液的装置(以铂为电极),A为电流表.电解一段时间t1后,将CO2持续通入电解液中.
| ||
| ||


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、水 |
| B、NaOH溶液 |
| C、K2CO3溶液 |
| D、NaNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
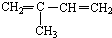 与Br2按物质的量之比1:1发生1,4加成反应方程式
与Br2按物质的量之比1:1发生1,4加成反应方程式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
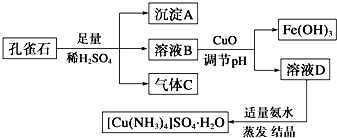
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其它 | 阳离子核外无电子 | 可做半导体材料 | 焰色反应呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放热的化学反应不需要加热就能发生 |
| B、物质燃烧不一定是放热反应 |
| C、化学反应除了生成新的物质外,还伴随着能量的变化 |
| D、吸热反应不加热就不会发生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com