
【题目】苯佐卡因(E)可用于化妆品紫外线吸收,局部麻醉药等。根据下面的反应路线可以实现苯佐卡因的制备及对糖厂甘蔗渣进行综合利用。
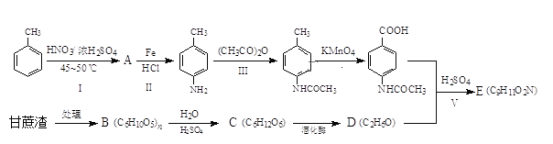
请回答下列问题:
(1)反应Ⅰ的化学方程式是_______________。
(2)B的名称是_____________,C中含有的官能团名称是______________。
(3)在反应Ⅰ~Ⅴ中,属于取代反应的是(填序号)________。
(4)写出反应Ⅴ的化学方程式:____________________________。
(5)苯佐卡因有多种同分异构体,其中,氨基直接连在苯环上,苯环上的一氯取代物只有一种的羧酸类同分异构体的结构简式为:_________________。
【答案】![]() +HNO3
+HNO3![]()
![]() +H2O 纤维素 羟基、醛基 Ⅰ、Ⅲ、Ⅴ
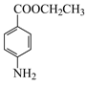
+H2O 纤维素 羟基、醛基 Ⅰ、Ⅲ、Ⅴ 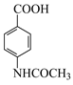 +CH3CH2OH
+CH3CH2OH![]()
 +CH3COOH
+CH3COOH 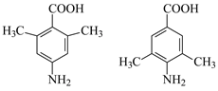
【解析】
(1)根据反应Ⅰ和反应II得出,反应I消化反应只能取代甲基对位上的氢原子,因此可写出反应方程式。
(2)甘蔗渣处理主要得到纤维素,纤维素最终水解生成葡萄糖,即可得出含有官能团。
(3)在反应Ⅰ~Ⅴ中,Ⅰ为硝化反应,Ⅲ是—COCH3取代—NH2中的氢,Ⅴ是酯化反应和水解反应。
(4)根据反应Ⅴ是酯化反应和水解反应,可得到反应方程式。
(5)苯佐卡因有多种同分异构体,其中,氨基直接连在苯环上,苯环上的一氯取代物只有一种的羧酸类,说明有对称性,再根据结构特点书写同分异构的结构简式。
(1)根据反应Ⅰ和反应II得出,反应I硝化反应只能取代甲基对位上的氢原子,其化学方程式是![]() +HNO3
+HNO3![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +HNO3
+HNO3![]()
![]() +H2O。
+H2O。
(2)甘蔗渣处理主要得到纤维素,因此B的名称是纤维素,纤维素最终水解生成葡萄糖,因此C中含有的官能团名称是羟基,醛基,故答案为:纤维素;羟基,醛基。
(3)在反应Ⅰ~Ⅴ中,Ⅰ为硝化反应也叫取代,Ⅲ是—COCH3取代—NH2中的氢,Ⅴ是酯化反应和水解反应,因此属于取代反应的是Ⅰ、Ⅲ、Ⅴ,故答案为:Ⅰ、Ⅲ、Ⅴ。
(4)反应Ⅴ是酯化反应和水解反应,因此化学方程式: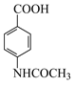 +CH3CH2OH
+CH3CH2OH![]()
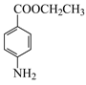 +CH3COOH,故答案为:
+CH3COOH,故答案为: +CH3CH2OH
+CH3CH2OH![]()
 +CH3COOH。
+CH3COOH。
(5)苯佐卡因有多种同分异构体,其中,氨基直接连在苯环上,苯环上的一氯取代物只有一种的羧酸类,说明有对称性,其同分异构体的结构简式为: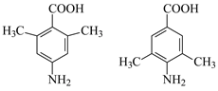 ,故答案为:
,故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.HClO、H2CO3、HNO3、HClO4的酸性依次增强
B.苹果酸![]() 含有1个手性碳原子
含有1个手性碳原子
C.HCl、NH3、C2H5OH均易溶于水的原因之一是三者与H2O分子间均易形成氢键
D.只含有极性共价键的分子不一定是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,也在染料工业中用作实效型气体吸收剂。利用废旧印刷电路板制氯化亚铜可减少污染、实现资源再生。请回答下列问题:
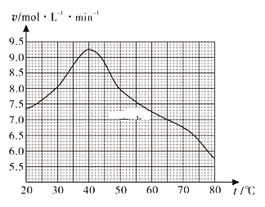
(1)废旧印刷电路板经粉碎分离能得到金属粉末,控制其他条件相同,用10%H2O2和3.0mol·L-1 H2SO4的混合溶液处理印刷电路板的金属粉末,测得不同温度下铜的平均溶解速率如图所示。在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的离子方程式为______。当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______。
(2)工业上常用CuSO4来制备CuCl。在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl,加热,生成CuCl沉淀,该反应的离子方程式是__________。
(3)在盐酸中CuCl能吸收CO,发生的反应为 CuCl+CO+H2O![]() Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
Cu(CO)Cl·H2O H<0,要加大CO的吸收率,适宜的条件是_____________。
(4)工业制备CuCl需要配制质量分数为20.0%的CuSO4溶液(密度为1.2g·cm-3),配制该溶液所需CuSO4·5H2O与H2O的质量之比为_______,所得溶液的物质的量浓度为______。
(5)工业检测CuCl产品的纯度需要80mL0.5mol/L的FeCl3溶液,配制该溶液所需仪器除托盘天平(含砝码、质量相同的两纸片)、烧杯外,还必需___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是四种常见有机物的比例模型,请回答下列问题:
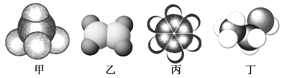
(1)丁的俗名是____,医疗上用于消毒的浓度是____。
(2)上述物质中,____(填名称)是种无色带有特殊气味的有毒液体,且不溶于水,密度比水小。向其中加入溴水,振荡静置后,观察到的现象是____
(3)乙与溴的四氯化碳溶液反应的生成物名称为____。写出在一定条件下,乙发生聚合反应生成高分子化合物的化学方程式:____
(4)甲是我国已启动的“西气东输”工程中的“气”(指天然气)的主要成分,其电子式为____,结构式为____,分子里各原子的空间分布呈____结构。
(5)用甲作燃料的碱性燃料电池中,电极材料为多孔情性金属电极,则负极的电极反应式为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸 H2Y 溶液中滴加 KOH 溶液,所得混合溶液的 pH 与离子浓度变化的关系如下图所示,下列有关说法错误的是

A. 曲线 M 表示 pH与 lg![]() 的变化关系
的变化关系
B. a点溶液中:c(H+) ― c(OH-)=2c(Y2-)+c(HY-) ― c(K+)
C. H2Y 的第二级电离常数Ka2(H2Y)=10-4.3
D. 交点b的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种新型锂电池装置,电池充、放电反应为xLi+LiV3O8![]() Li1+xV3O8。放电时,需先引发铁和氯酸钾反应使共晶盐熔化,下列说法正确的是( )
Li1+xV3O8。放电时,需先引发铁和氯酸钾反应使共晶盐熔化,下列说法正确的是( )
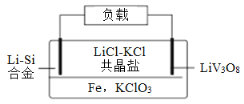
A.整个过程的能量转化只涉及化学能转化为电能
B.放电时,KClO3在正极发生还原反应
C.充电时,阳极反应为Li1+xV3O8-xe-=xLi++LiV3O8
D.放电时,转移xmol电子理论上Li-Si合金净减7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,向1L固定容积的密闭容器中加入2molX和1molY,发生反应:2X(g)+Y(g)![]() aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)。当反应达到平衡状态后,放出的热量为Q1kJ;若平衡后再升高温度,混合气体的平均相对分子质量减小。下列说法正确的是( )
aZ(g)+W(g) ΔH=-QkJ/mol(Q>0)。当反应达到平衡状态后,放出的热量为Q1kJ;若平衡后再升高温度,混合气体的平均相对分子质量减小。下列说法正确的是( )
A.a=3
B.T℃达到平衡状态时,X的转化率为![]()
C.达到平衡状态后向容器中加入一定量的氦气,正逆反应速率均增大
D.当容器内气体的密度一定时表明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 12C、13C、14C是碳的三种同素异形体
B. H2S的电子式可表示为![]()
C. HCl、HBr、HI的稳定性逐渐减弱,而熔沸点逐渐升高
D. NaHSO4在熔融状态下不仅破坏了离子键,还破坏了共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com