
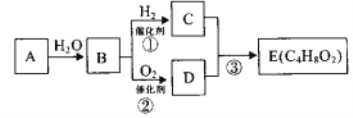
ЎҫМвДҝЎҝМюAФЪТ»¶ЁМхјюПВҝЙТФЧӘ»ҜОӘУР»ъОпEЈ¬ЖдЧӘ»Ҝ№ШПөИзПВНјЎЈТСИзМюAФЪұкЧјЧҙҝцПВөДГЬ¶ИОӘ1.16g/L,јУИИКұBУлРВЦЖЗвСх»ҜНӯІъЙъЧ©әмЙ«іБөнЎЈEОӘУРЕЁУфПгО¶ЎўІ»ТЧИЬУЪЛ®өДУНЧҙТәМеЎЈ
Зл»Шҙр:
ЈЁ1Ј©BЦР№ЩДЬНЕөДҪб№№јтКҪОӘ_____Ј¬CЦР№ЩДЬНЕөДГыіЖОӘ______Ј¬EөДәЛҙЕ№ІХсЗвЖЧНјЦРУР_____Чй·еЎЈ
ЈЁ2Ј©Рҙіц»ҜС§·ҪіМКҪ:
ўЪ____________Ј»ўЫ__________ЎЈ
ЈЁ3Ј©ПВБРЛө·ЁХэИ·өДКЗ______ (МоұкәЕ)ЎЈ
a.CОпЦКУлҪрКфЦЖ·ҙУҰұИЛ®УлҪрКфДЖ·ҙУҰёьҫзБТ
b.УР»ъОпCЎўDЎўEҝЙУГұҘәНNa2CO3ИЬТәјшұр
c.КөСйКТЦЖёчEКұЈ¬јУИлЕЁСОЛбЧцҙЯ»ҜјБ
d.BДЬұ»ЛбРФKMnO4ИЬТәСх»Ҝ
Ўҫҙр°ёЎҝ ЎӘCHO фЗ»щ 3 2CH3CHO +O2![]() 2CH3COOH CH3COOH+CH3CH2OH
2CH3COOH CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O bd
CH3COOCH2CH3+H2O bd
ЎҫҪвОцЎҝМюAФЪұкЧјЧҙҝцПВөДГЬ¶ИОӘ1.16g/LЈ¬Фт![]() Ј¬ФтAОӘТТИІЈ¬ТТИІУлЛ®·ўЙъјУіЙ·ҙУҰЙъіЙBОӘТТИ©Ј¬ТТИ©УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙCОӘТТҙјЈ¬ТТИ©ҙЯ»ҜСх»ҜЙъіЙDОӘТТЛбЈ¬ТТЛбәНТТҙј·ўЙъхҘ»Ҝ·ҙУҰЙъіЙEОӘТТЛбТТхҘЎЈЈЁ1Ј©BОӘТТИ©Ј¬№ЩДЬНЕөДҪб№№јтКҪОӘЎӘCHOЈ¬CОӘТТҙјЈ¬№ЩДЬНЕөДГыіЖОӘфЗ»щЈ¬EОӘТТЛбТТхҘЈ¬Ҫб№№јтКҪОӘCH3COOCH2CH3Ј¬әЛҙЕ№ІХсЗвЖЧНјЦРУР3Чй·еЈ»ЈЁ2Ј©ўЪОӘТТИ©ҙЯ»ҜСх»ҜЙъіЙDОӘТТЛбЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ: 2CH3CHO +O2
Ј¬ФтAОӘТТИІЈ¬ТТИІУлЛ®·ўЙъјУіЙ·ҙУҰЙъіЙBОӘТТИ©Ј¬ТТИ©УлЗвЖш·ўЙъјУіЙ·ҙУҰЙъіЙCОӘТТҙјЈ¬ТТИ©ҙЯ»ҜСх»ҜЙъіЙDОӘТТЛбЈ¬ТТЛбәНТТҙј·ўЙъхҘ»Ҝ·ҙУҰЙъіЙEОӘТТЛбТТхҘЎЈЈЁ1Ј©BОӘТТИ©Ј¬№ЩДЬНЕөДҪб№№јтКҪОӘЎӘCHOЈ¬CОӘТТҙјЈ¬№ЩДЬНЕөДГыіЖОӘфЗ»щЈ¬EОӘТТЛбТТхҘЈ¬Ҫб№№јтКҪОӘCH3COOCH2CH3Ј¬әЛҙЕ№ІХсЗвЖЧНјЦРУР3Чй·еЈ»ЈЁ2Ј©ўЪОӘТТИ©ҙЯ»ҜСх»ҜЙъіЙDОӘТТЛбЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ: 2CH3CHO +O2![]() 2CH3COOHЈ»ўЫОӘТТЛбәНТТҙј·ўЙъхҘ»Ҝ·ҙУҰЙъіЙEОӘТТЛбТТхҘЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ: CH3COOH+CH3CH2OH
2CH3COOHЈ»ўЫОӘТТЛбәНТТҙј·ўЙъхҘ»Ҝ·ҙУҰЙъіЙEОӘТТЛбТТхҘЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ: CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2OЈ»ЈЁ3Ј©a.CОӘТТҙјЈ¬КфУЪ·ЗөзҪвЦКЈ¬УлҪрКфДЖ·ҙУҰұИЛ®УлҪрКфДЖ·ҙУҰ»әәНЈ¬№КҙнОуЈ»b.УР»ъОпCЎўDЎўEҝЙУГұҘәНNa2CO3ИЬТәјшұрЈ¬ПЦПу·ЦұрОӘОЮГчПФПЦПуЈ¬УРЖшЕЭІъЙъЎў·ЦІгЈ¬№КХэИ·Ј»c.КөСйКТЦЖұёТТЛбТТхҘКұЈ¬јУИлЕЁБтЛбЧцҙЯ»ҜјБЈ¬№КҙнОуЈ»d.ТТИ©ДЬұ»ЛбРФKMnO4ИЬТәСх»ҜЈ¬№КХэИ·ЎЈҙр°ёСЎbdЎЈ
CH3COOCH2CH3+H2OЈ»ЈЁ3Ј©a.CОӘТТҙјЈ¬КфУЪ·ЗөзҪвЦКЈ¬УлҪрКфДЖ·ҙУҰұИЛ®УлҪрКфДЖ·ҙУҰ»әәНЈ¬№КҙнОуЈ»b.УР»ъОпCЎўDЎўEҝЙУГұҘәНNa2CO3ИЬТәјшұрЈ¬ПЦПу·ЦұрОӘОЮГчПФПЦПуЈ¬УРЖшЕЭІъЙъЎў·ЦІгЈ¬№КХэИ·Ј»c.КөСйКТЦЖұёТТЛбТТхҘКұЈ¬јУИлЕЁБтЛбЧцҙЯ»ҜјБЈ¬№КҙнОуЈ»d.ТТИ©ДЬұ»ЛбРФKMnO4ИЬТәСх»ҜЈ¬№КХэИ·ЎЈҙр°ёСЎbdЎЈ


 ЦРҝјҪв¶Бҝјөгҫ«Б·ПөБРҙр°ё
ЦРҝјҪв¶Бҝјөгҫ«Б·ПөБРҙр°ё
| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіОВ¶ИПВЈ¬Ҫ«0.2 molCЈЁSЈ©әН0.3 mol H2OЈЁgЈ©Н¶Ил2LөДГЬұХИЭЖчЦРЈ¬·ўЙъ·ҙУҰCЈЁSЈ©+H2OЈЁgЈ©![]() CO + H2 5minҙпөҪЖҪәвәуЈ¬ГЬ¶ИФцјУБЛ0.3g/LЎЈУР№ШПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
CO + H2 5minҙпөҪЖҪәвәуЈ¬ГЬ¶ИФцјУБЛ0.3g/LЎЈУР№ШПВБРЛө·ЁХэИ·өДКЗЈЁ Ј©
A. ҙУ·ҙУҰҝӘКјөҪЖҪәв№эіМЦРЈ¬УГCАҙұнКҫёГ·ҙУҰөДЖҪҫщЛЩВКОӘ0.005 molL-1min-1
B. ҙпЖҪәвКұС№ЗҝұдОӘФӯАҙөД7/6
C. ҙЛОВ¶ИПВёГ·ҙУҰөДЖҪәвіЈКэОӘ0.0125
D. ИфұЈіЦОВ¶ИәНМе»эІ»ұдЈ¬ПтЖҪәвМеПөЦРФЩјУИл0.2 molCЈЁSЈ©әН0.3 mol H2OЈЁgЈ©Ј¬ЦШРВҙпөҪЖҪәвәуЈ¬H2OөДЧӘ»ҜВКөИУЪ16.7%
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘУРПВНјЛщКҫОпЦКПа»ҘЧӘ»»№ШПө

КФ»ШҙрЈә
ЈЁ1Ј©РҙіцBөД»ҜС§КҪ__________Ј¬DөД»ҜС§КҪ__________Ј»
ЈЁ2Ј©РҙіцУЙEЧӘұдіЙFөД»ҜС§·ҪіМКҪ__________Ј»
ЈЁ3Ј©ПтGИЬТәЦРјУИлAөДАлЧУ·ҪіМКҪ__________Ј»
ПтGИЬТәЦРјУИлНӯЖ¬өДАлЧУ·ҪіМКҪ__________Ј»
ЈЁ4Ј©јтКцBИЬТәЦРСфАлЧУөДјмСй·Ҫ·Ё__________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТ»¶ЁМхјюПВҪ«ЦКБҝm gөДУР»ъОпФЪСхЖшЦРНкИ«ИјЙХЈ¬ИјЙХәуИ«ІҝІъОп»әВэНЁ№эЧгБҝ№эСх»ҜДЖЈ¬ід·Ц·ҙ
УҰәу№эСх»ҜДЖ№ММеФцЦШn gЈ¬№ШУЪПВБРЗйҝцЛө·ЁХэИ·өДКЗ
УР»ъОп | n | |
A | CH4 | 2m |
B | HCHO | 3m/2 |
C | CH3OHәНCH3COOHөД»мәПОп | 2m/3 |
D | C2H5OHәНCH3COOC2H5өД»мәПОп | m |
A. A B. B C. C D. D
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПЦУРAЎўBЎўCЎўDЎўEЎўFБщЦЦЧ°ЦГЈ¬ИзНјЛщКҫЎЈ(ҪәИыЎўөј№ЬҝЙЧФУЙСЎУГ)ЎЈТСЦӘЈәКөСйКТҝЙУГПВБР·ҙУҰЦЖИЎСхЖш2KClO3![]() 2KClЈ«3O2Ўь
2KClЈ«3O2Ўь
(1)РҙіцТЗЖчГыіЖЈәўЩ________Ј¬ўЪ________ЎЈ
(2)КөСйКТЦЖИЎІўКХјҜСхЖшКұЈ¬УҰСЎФс____________әН________ПаБ¬ҪУЎЈ
(3)ЧцДҫМҝ»№ФӯСх»ҜНӯІўјмСйЙъіЙЖшМеөДКөСйКұЈ¬УҰСЎФс________әН________ПаБ¬ҪУЈ¬јмСйЙъіЙЖшМеКұК№УГөДКФјБКЗ________Ј¬јмСйЖшМеКұ№ЫІмөҪөДКөСйПЦПуКЗ_________________ЎЈ
(4)ЦЖИЎЗвЖшІўЧц»№ФӯСх»ҜНӯөДКөСйКұЈ¬УҰСЎФс______әН________Ч°ЦГЈ¬КөСйҪбКшКұУҰПИНЈЦ№јУИИЈ¬ҙэКФ№ЬАдИҙәуЈ¬ФЩНЈЦ№НЁЗвЖшЈ¬ЖдФӯТтКЗ_______________________________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЕдЦЖ100 mL 1.0 molЈҜLNa2CO3ИЬТәЈ¬ПВБРІЩЧчХэИ·өДКЗ
A. іЖИЎ10.6 gОЮЛ®МјЛбДЖЈ¬јУИл100 mLИЭБҝЖҝЦРЈ¬јУЛ®ИЬҪвЎў¶ЁИЭ
B. іЖИЎ10.6 gОЮЛ®МјЛбДЖЈ¬јУИл100 mLХфБуЛ®Ј¬ҪБ°иЎўИЬҪв
C. ЧӘТЖNa2CO3ИЬТәКұЈ¬ОҙУГІЈБ§°фТэБчЈ¬ЦұҪУө№ИлИЭБҝЖҝЦР
D. ¶ЁИЭәуЈ¬ИыәГЖҝИыЈ¬·ҙёҙө№ЧӘЎўТЎФИ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝДіКөСйРЎЧйН¬С§ТАҫЭЧКБПЙоИлМҪҫҝFe3+ФЪЛ®ИЬТәЦРөДРРОӘЎЈ
ЧКБПЈәiЈ®Fe3+ ФЪЛ®ИЬТәЦРТФЛ®әПМъАлЧУөДРОКҪҙжФЪЈ¬Из[Fe(H2O)6]3+Ј»
[Fe(H2O)6]3+·ўЙъИзПВЛ®Ҫв·ҙУҰЈә
[Fe(H2O)6]3+(јёәхОЮЙ«)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(»ЖЙ«)+nH3O+(n=0Ў«6)Ј»
[Fe(H2O)6-n(OH)n]3-n(»ЖЙ«)+nH3O+(n=0Ў«6)Ј»
ii.[FeCl4(H2O)2]-ОӘ»ЖЙ«ЎЈ
ЎҫКөСйIЎҝ

ЎҫКөСйIIЎҝ
·ЦұрУГКФ№ЬўЩЎўўЫЦРөДКФјБЧчОӘҙэІвТәЈ¬УГЙ«¶ИјЖІв¶ЁЖдНё№вВКЎЈНё№вВКФҪРЎЈ¬ИЬТәСХЙ«ФҪЙоЈ»Нё№вВКФҪҙуЈ¬ИЬТәСХЙ«ФҪЗіЎЈ


Нј1 Нј2
Fe(NO3)3ИЬТәНё№вВКЛжОВ¶Иұд»ҜЗъПЯ FeCl3ИЬТәНё№вВКЛжОВ¶Иұд»ҜЗъПЯ
ЈЁ1Ј©КөСйIЦРЈ¬КФ№ЬўЪИЬТәұдОӘОЮЙ«өДФӯТтКЗ ЎЈ
ЈЁ2Ј©КөСйIЦРЈ¬КФ№ЬўЫИЬТәіКЧШ»ЖЙ«Ул[FeCl4(H2O)2]-УР№ШЈ¬Ц§іЦҙЛҪбВЫөДКөСйПЦПуКЗ ЎЈ
ЈЁ3Ј©УЙКөСйIIНј1Ўў2ҝЙЦӘЈәјУИИКұЈ¬ИЬТәСХЙ« ЈЁМоЎ°ұдЗіЎұЎўЎ°ұдЙоЎұ»тЎ°І»ұдЎұЈ©ЎЈ
ЈЁ4Ј©УЙКөСйIIЈ¬ҝЙТФөГіцИзПВҪбВЫЈә
[ҪбВЫТ»]FeCl3ИЬТәЦРҙжФЪҝЙДж·ҙУҰЈә[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-
[Fe(H2O)6]3++4Cl-
өГіцҙЛҪбВЫөДАнУЙКЗ ЎЈ
[ҪбВЫ¶ю] ҪбВЫТ»ЦР·ҙУҰөДҰӨH ЈЁМоЎ°>0Ўұ»тЎ°<0ЎұЈ©ЎЈ
ЈЁ5Ј©КөСйРЎЧйН¬С§ЦШРВЙијЖБЛТ»ёцКөСйЦӨГчЈЁ4Ј©ЦРҪбВЫТ»ЎЈКөСй·Ҫ°ёЈәИЎКФ№ЬўЩЦРИЬТәЈ¬ ЈЁЗлГиКцұШТӘөДКөСйІЩЧчәНПЦПуЈ©ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝЗҰөҘЦКј°Жд»ҜәПОпФЪРВДЬФҙБмУтУҰУГ№г·әЈ¬№ӨТөЙПАыУГ·ҪЗҰҫ«ҝуЈЁЦчТӘіЙ·ЦОӘPbSЈ©ЦЖұёPbSO4өД№ӨТХБчіМИзПВЈә
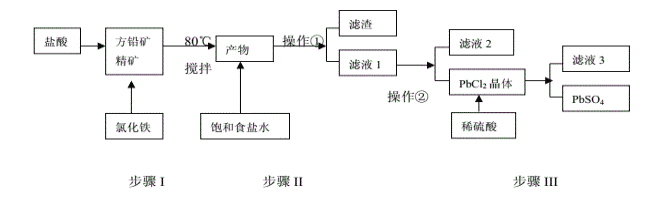
ТСЦӘЈәўЩPbCl2ЈЁsЈ©+2ClЈӯ(aq)![]() PbCl4-(aq) ЎчHЈҫ0 ўЪKsp(PbSO4)=1.0ЎБ10-8,Ksp(PbCl2)=1.6ЎБ10-5ўЫFe3Ј«ЎўPb2Ј«ТФЗвСх»ҜОпРОКҪНкИ«іБөнКұЈ¬ИЬТәөДpHЦө·ЦұрОӘ3.2Ўў7.0ЎЈ
PbCl4-(aq) ЎчHЈҫ0 ўЪKsp(PbSO4)=1.0ЎБ10-8,Ksp(PbCl2)=1.6ЎБ10-5ўЫFe3Ј«ЎўPb2Ј«ТФЗвСх»ҜОпРОКҪНкИ«іБөнКұЈ¬ИЬТәөДpHЦө·ЦұрОӘ3.2Ўў7.0ЎЈ
ЈЁ1Ј©ІҪЦиўсЦР·ўПЦУРөӯ»ЖЙ«іБөнЙъіЙЈ¬ЗлРҙіцАлЧУ·ҙУҰ·ҪіМКҪЈә_______________________Ј»
ЈЁ2Ј©ІҪЦиўсФӯБПФӨҙҰАн№эіМЦРРҙіцТ»ЦЦіэҪБ°иНвјУҝм·ҙУҰЛЩВКөД°м·ЁЈә_________________Ј»·ҙУҰОВ¶ИІ»ТЛ№эёЯЈ¬ЗТРијУИл№эБҝСОЛбұЈЦӨИЬТәіКЗҝЛбРФЈ¬ФӯТтКЗЈә____________________Ј»
ЈЁ3Ј©ІЩЧчўЩУҰОӘЈә_______ Ј»ІЩЧчўЪУҰОӘЈә_________ Ј»
AЎўіГИИ№эВЛ BЎўХф·ўЕЁЛхЈ¬АдИҙҪбҫ§Ј» CЎўХф·ўҪбҫ§ DЎўЦШҪбҫ§
ЈЁ4Ј©РҙіцІҪЦиIIIЦРPbCl2ЙъіЙPbSO4өДАлЧУ·ҙУҰ·ҪіМКҪЈә___________________________ Ј¬ёГ·ҙУҰөДЖҪәвіЈКэK=_______Ј»
ЈЁ5Ј©ЗҰРоөзіШЈЁPb-PbO2-H2SO4Ј©ідөзКұөДСфј«·ҙУҰ·ҪіМКҪЈә_________________________ Ј»
ЈЁ6Ј©ДіЗҰРоөзіШ·ЕөзКұөзБчОӘ0.2AЈ¬ҝЙіЦРш·ЕөзКұјд96500sЈ¬ҙЛКұІОјУ·ҙУҰөДPbөДЦКБҝОӘ41.4gЈ¬ЗуёГөзіШ·ЕөзөДДЬБҝЧӘ»ҜВКҰБ=_________ ЎЈЈЁөзіШДЬБҝЧӘ»ҜВКөД¶ЁТеЈәҰБ=КөјККдіцөзБҝ/АнВЫКдіцөзБҝЎБ100%Ј¬Ҫб№ыұЈБфБҪО»УРР§КэЧЦЈ¬ТСЦӘ·ЁАӯөЪіЈКэОӘ96500C/molЈ©
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ100kPaКұЈ¬·ҙУҰ2NO(g)+O2(g)![]() 2NO2(g)ЦРNOөДЖҪәвЧӘ»ҜВКУлОВ¶ИөД№ШПөЗъПЯИзНј1Ј¬·ҙУҰ2NO2(g)
2NO2(g)ЦРNOөДЖҪәвЧӘ»ҜВКУлОВ¶ИөД№ШПөЗъПЯИзНј1Ј¬·ҙУҰ2NO2(g)![]() N2O4(g)ЦРNO2өДЖҪәвЧӘ»ҜВКУлОВ¶ИөД№ШПөЗъПЯИзНј2ЎЈ
N2O4(g)ЦРNO2өДЖҪәвЧӘ»ҜВКУлОВ¶ИөД№ШПөЗъПЯИзНј2ЎЈ
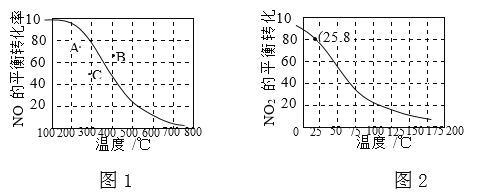
ўЩ Нј1ЦРAЎўBЎўCИэөгұнКҫІ»Н¬ОВ¶ИЎўС№ЗҝПВ2NO(g)+O2(g)![]() 2NO2(g)ҙпөҪЖҪәвКұNOөДЧӘ»ҜВКЈ¬Фт________өг¶ФУҰөДС№ЗҝЧоҙуЎЈ
2NO2(g)ҙпөҪЖҪәвКұNOөДЧӘ»ҜВКЈ¬Фт________өг¶ФУҰөДС№ЗҝЧоҙуЎЈ
ўЪ 100kPaЎў25ЎжКұЈ¬2NO2(g)![]() N2O4(g)ЖҪәвМеПөЦРЈ¬БРКҪјЖЛгЖҪәвіЈКэKpЈҪ________ЎЈЈЁKpУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЈ¬·ЦС№ЈҪЧЬС№ЎБОпЦКөДБҝ·ЦКэЈ©
N2O4(g)ЖҪәвМеПөЦРЈ¬БРКҪјЖЛгЖҪәвіЈКэKpЈҪ________ЎЈЈЁKpУГЖҪәв·ЦС№ҙъМжЖҪәвЕЁ¶ИјЖЛгЈ¬·ЦС№ЈҪЧЬС№ЎБОпЦКөДБҝ·ЦКэЈ©
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com