
【题目】已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H=﹣24.8kJ/mol.
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H=﹣47.2kJ/mol.
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H=+640.5kJ/mol.
则7g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为( )
A.+54.5 kJ/mol
B.﹣218 kJ/mol
C.﹣54.5 kJ/mol
D.+218 kJ/mol
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】将N2和 H2按一定比例混合,在相同状况下其密度是H2的3.6倍,取0.5mol该混合气体通入密闭容器内,使之发生反应并在一定条件下达到平衡.已知反应达到平衡后容器内压强是相同条件下反应前压强的0.76倍,试求:
(1)反应前混合气体的平均相对分子质量为;其中N2和 H2的体积比等于;
(2)达到平衡时混合气体中的氨的物质的量等于
(3)平衡时N2的转化率等于
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生成高分子化合物的反应有加聚反应和缩聚反应,今有某高分子化合物的结构片断如下:…CH2-CH2-CH2-CH2-CH2-CH2…,生成该高分子化合物的反应类型肯定不是下列反应中的( )
A.加成反应
B.聚合反应
C.加聚反应
D.缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
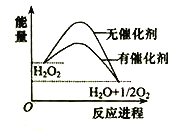
A. 加入催化剂,减小了反应的热效应
B. 加入催化剂,可提高H2O2的平衡转化率
C. H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D. 反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S8分子形成的单斜硫和斜方硫是同素异形体,转化关系如下S(斜方,固) ![]() S(单斜,固) ΔH=+0.398 kJ·mol-1若NA为阿伏加德罗常数,则下列说法中,不正确的是( )
S(单斜,固) ΔH=+0.398 kJ·mol-1若NA为阿伏加德罗常数,则下列说法中,不正确的是( )
A. 单斜硫比斜方硫具有的能量略高
B. 单斜硫和斜方硫之间的转化属于物理变化
C. 单斜硫和斜方硫在充足的氧气中燃烧均生成SO2
D. 64 g单斜硫和斜方硫的混合物含硫原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
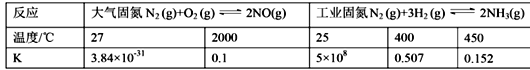
①分析数据可知:大气固氮反应属于 _______(填“吸热”或“放热”)反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 _____________________________________________。
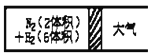
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
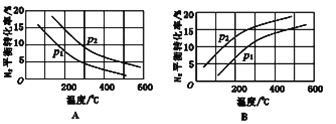
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系: p1_______________p2(填“>”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列试剂的保存方法正确的是
A. 氢氟酸存放在玻璃瓶中 B. NaOH溶液存在带橡皮塞的玻璃瓶中
C. 水玻璃存放在滴瓶中 D. 金属钠保存在冷水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是
A. KClO3+6HC1=KCl+3C12↑+3H2O 中,生成13.44L (标准状况) C12转移电子数为1.2 NA
B. 标准状况下,22.4LC12通入足量水中转移电子数为NA
C. 足量的MnO2与一定量的浓盐酸反应得到1mol Cl2,若向反应后的溶液中加入足量的AgNO3,则生成AgC1的物质的量为2 mol
D. 5.6g Fe 与一定量的稀硝酸反应,转移电子数可能为0.26 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com