
【题目】氮的固定是几百年来科学家一直研究的课题。
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
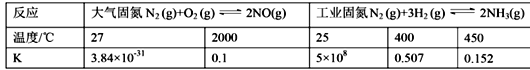
①分析数据可知:大气固氮反应属于 _______(填“吸热”或“放热”)反应。
②从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 _____________________________________________。
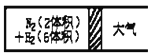
③在一定的温度下,把2体积N2和6体积H2分别通入一个带活塞的体积可变的容器中,活塞的一端与大气相通容器中发生如下反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
2NH3(g) △H<0。反应达到平衡后,测得混合气体为7体积。达到平衡时N2的转化率_______________________。
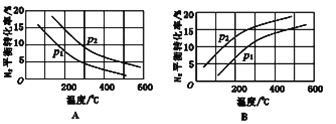
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(P1、P2)下随温度变化的曲线,下图所示的图示中,正确的是_______(填“A”或“B”);比较p1、p2的大小关系: p1_______________p2(填“>”或“<”)。
【答案】 吸热 从反应速率角度考虑,高温更好,从催化剂活性等综合因素考虑选择500℃左右合适 25% A <
【解析】(1)①由表格数据可知,大气固氮温度越高,K越大,说明升高温度,平衡正移,则正反应方向为吸热反应,
故答案为:吸热;
②由表格数据可知,合成氨反应温度越高,K越小,说明合成氨反应为放热反应,温度高转化率会降低,所以从平衡的视角来看,工业固氮应该选择常温条件;但是常温下,合成氨反应速率小,效率低,而且在500℃左右催化剂活性最高,所以从催化剂活性、化学反应速率等综合因素考虑选择500℃左右合适。
故答案为:从反应速率角度考虑,高温更好,从催化剂活性等综合因素考虑选择500℃左右合适。
③恒温恒压下,气体体积之比等于物质的量之比。平衡之后,气体由8体积变为7体积,则体积变化量为1。
根据方程式可知: N2(g)+3H2(g)2NH3(g)~△v
1 2
0.5 1
所以,氮气反应了0.5体积,转化率为: ![]()
故答案为:25%
(2)合成氨反应为放热反应,升高温度,转化率减小,所以图A正确,B错误;该反应正方向为体积减小的方向,增大压强平衡正向移动,转化率增大,p2的转化率大,则p2大,p2>p1。
故答案为:A;p2>p1;


 华东师大版一课一练系列答案
华东师大版一课一练系列答案 孟建平名校考卷系列答案
孟建平名校考卷系列答案科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
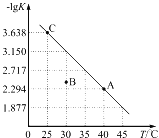
A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,0.10mol/LH2A溶液用0.10mol/LNaOH溶液滴定,滴定曲线如下图所示:

已知:①pKa=-lgKa;②二元弱酸H2A的酸式盐NaHA溶液中的c(H+)=![]()
下列说法正确的是
A. 可用甲基橙作滴定指示剂 B. X点溶液pH=6.4
C. 反应H2A+A2-=2HA-的PK=9.7 D. Y点溶液中c(Na+)=c(OH-)+3c(HA-)-c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g),△H=﹣24.8kJ/mol.
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g),△H=﹣47.2kJ/mol.
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g),△H=+640.5kJ/mol.
则7g CO气体还原足量FeO固体得到固体Fe和CO2气体时,对应的△H为( )
A.+54.5 kJ/mol
B.﹣218 kJ/mol
C.﹣54.5 kJ/mol
D.+218 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组数据比较,前者比后者小的是
A.氯水与氨水中微粒种类B.乙烷与苯分子中碳碳键键长
C.氯化铯与氯化钠的熔点D.Al2O3与AlCl3的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联合国气候变化大会于2009年12月7~18日在哥本哈根召开.中国政府承诺到2020年,单位GDP二氧化碳排放比2005年下降40%~45%.
(1)有效“减碳”的手段之一是节能.下列制氢方法最节能的是
A.电解水制氢:2H2O2H2↑+O2↑
B.高温使水分解制氢:2H2O2H2↑+O2↑
C.太阳光催化分解水制氢:2H2O TiO2太阳光 2H2↑+O2↑
D.天然气制氢:CH4+H2O CO+3H2
(2)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
已知:CO(g)+2H2(g)═CH3OH(g)△H=﹣90.7kJmol﹣1
2CH3OH(g)═CH3OCH3(g)+H2O(g)△H=﹣23.5kJmol﹣1
CO(g)+H2O(g)═CO2(g)+H2(g)△H=﹣41.2kJmol﹣1
则CO2和氢气合成CH3OCH3(g)的热化学方程式为
(3)在催化剂和一定温度、压强条件下,CO与H2可反应生成甲醇:CO(g)+2H2(g)CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:p1p2(填“<”、“>”或“=”下同),上述反应的△H0. 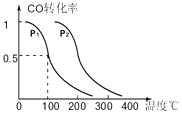
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华人民共和国国家标准(GB2760﹣2011)规定葡萄酒中SO2最大使用量为0.25g/L.某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中SO2 , 并对含量进行测定. 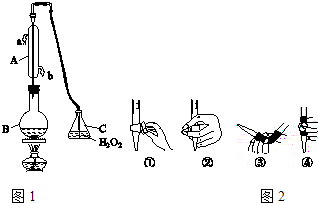
(1)仪器A的名称是 , 水通入A的进口为
(2)B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为 .
(3)除去C中过量的H2O2 , 然后用0.0450mol/LNaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的(填数字编号);若滴定终点时溶液的pH=8.8,则选择的指示剂为
(4)滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为:g/L.
(5)该测定结果比实际值偏高的原因是,利用现有装置的改进措施是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】航天科学家正在考虑用塑料飞船代替铝制飞船,进行太空探索。其依据是( )
A.塑料是一种高分子化合物,可以通过取代反应大量生产
B.塑料生产中加入添加剂可得到性能比铝优良的新型材料
C.塑料用途广泛,可从自然界中直接得到
D.塑料是有机物,不会和强酸强碱作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各工业生产中,石灰石、生石灰、熟石灰都不能作为原料的是( )
①炼铁 ②用生铁炼钢 ③从海水中提取镁 ④铝的冶炼 ⑤制水泥 ⑥制玻璃 ⑦制漂白粉 ⑧制硫酸
A.④⑧
B.⑤⑥
C.①②③
D.⑤⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com