
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。它易溶于水,不溶于乙醇,具有较强的还原性,可应用于照相等工业中。回答下列问题:
(1)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_________________________________________。
(2)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为_________________________________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________(填试剂名称),若____________(填现象),则证明产品中含有Na2SO3和Na2SO4。
③粗品中Na2S2O3·5H2O的质量分数的测定称取5g粗品配制250 mL的溶液待用。另取25.00 mL 0.0100 mol· L-1K2Cr2O7溶液于锥形瓶中,然后加入过量酸化的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL。滴定终点的现象是____________________。请写出K2Cr2O7溶液加入过量酸化的KI溶液反应的例子方程式:____________________________________________。粗品中Na2S2O3·5H2O的质量分数为_________。(已知I2+2S2O32-=2I-+S4O62-)
【答案】S2O32-+2H+=S↓+SO2↑+H2ONa2SO3+S+5H2O=Na2S2O3·5H2O稀盐酸沉淀未完全溶解,并有刺激性气味的气体生成蓝色溶液恰好消失且30s不变色Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O74.4%
【解析】
(1)酸性条件下,S2O32-自身发生氧化还原反应生成SO2和S。
(2)①Na2SO3和S在水溶液化合。
②检验Na2SO3中的Na2SO4杂质,要先用盐酸除去亚硫酸钠,再检验硫酸根离子;
③I2遇淀粉显蓝色;Cr2O72-将I-氧化成I2自身还原为Cr3+;根据反应消耗的Cr2O72-的物质的量计算Na2S2O3的物质的量,再计算Na2S2O3·5H2O的质量分数。
(1)酸性条件下,S2O32-自身发生氧化还原反应生成SO2和S,Na2S2O3与盐酸反应的离子方程式:S2O32-+2H+=S↓+SO2↑+H2O;
(2)①Na2SO3和S在水溶液化合,方程式:Na2SO3+S+5H2O=Na2S2O3·5H2O;
②检验Na2SO3中的Na2SO4杂质,要先用盐酸除去亚硫酸钠,再检验硫酸根离子;其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量稀盐酸,若沉淀未完全溶解,并有刺激性气味的气体生成,则证明产品中含有Na2SO3和Na2SO4。
③I2+2S2O32-=2I-+S4O62-,反应终点时,碘消耗完,故终点现象为:蓝色溶液恰好消失且30s不变色;.Cr2O72-将I-氧化成I2自身还原为Cr3+,方程式为:Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O;
250mL中n(Cr2O72-)=250.00 ×10-3×L 0.0100 mol· L-1=2.5×10-3mol
Cr2O72-~~3I2~~6Na2S2O3·5H2O
1 6
2.5×10-3mol 1.5×10-2mol
因此Na2S2O3·5H2O的质量分数=0.0025mol×6×248g·mol-1/5.00g×100%=74.4%


科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】假定把12C的相对原子质量定为24,把24g12C含有的原子个数定为阿伏加德罗常数,而物质的量的概念不变。则下列推断不正确的是
A. 此时16O的相对原子质量为32
B. 40gNaOH溶于水配成1L溶液,其物质的量浓度为1 mol/L
C. 标况下44gCO2的体积为22.4L
D. NA个氧分子与NA个氢分子有相同数目的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2g (已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是

A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中SO42-物质的量为0.6 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20mL原混合酸加水稀释至1L后溶液的c(H+)=0.2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化亚铜可用作工业催化剂,是一种白色粉末,微溶于冷水,不溶于乙醇等有机溶剂,在热水中或见光都会分解,在空气中会慢慢氧化成绿色粉末。制备CuBr的实验步骤如下:

步骤1.在如上图所示的三颈烧瓶中加入45gCuSO4·5H2O、19gNaBr、150mL煮沸过的蒸馏水,60℃时不断搅拌,以适当流速通入SO2 2小时。
步骤2.溶液冷却后倾去上层清液,在避光的条件下过滤。
步骤3.依次用溶有少量SO2的水、溶有少量SO2的乙醇、纯乙醚洗涤
步骤4.在双层干燥器(分别装有浓硫酸和氢氧化钠)中干燥3~4h,再经氢气流干燥,最后进行真空干燥。
(1)实验所用蒸馏水需经煮沸,煮沸目的是除去水中的________________(写化学式)。
(2)步骤1中:①三颈烧瓶中反应生成CuBr的离子方程式为__________________;
②控制反应在60℃进行,实验中可采取的措施是____________________;
③说明反应已完成的现象是_____________________ 。
(3)步骤2过滤需要避光的原因是_____________________。
(4)步骤3中洗涤剂需“溶有SO2”的原因是____________________。
(5)欲利用上述装置烧杯中的吸收液(经检测主要含Na2SO3、NaHSO3等)制取较纯净的Na2SO3·7H2O晶体。
请补充实验步骤[须用到SO2(贮存在钢瓶中)、20%NaOH溶液]:
①_________________。
②___________________。
③加入少量维生素C溶液(抗氧剂),蒸发浓缩,冷却结晶。
④过滤,用乙醇洗涤2~3次。⑤放真空干燥箱中干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应的叙述正确的是( )
A.用酒精灯加热Fe(OH)3生成FeOB.实验室加热NH4Cl固体制取NH3
C.SO2和过量氨水反应生成(NH4)2SO3D.Na在空气中燃烧制取Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于单质铁的性质,下列说法中正确的是( )
A.铁与高温水蒸气反应生成Fe2O3B.铁与硫单质反应生成Fe2S3
C.生铁是一种铁-碳合金D.常温下,冷的浓硫酸与铁单质不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
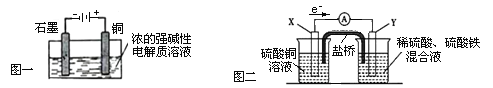
A.Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如图一所示,石墨电极上产生氢气,铜电极发生氧化反应
B.图一所示当有0.1mol电子转移时,有0.1molCu2O生成
C.图二装置中发生:Cu+2Fe3+ = Cu2+ +2Fe2+ ,X极是负极,Y极材料可以是铜
D.如图二,盐桥的作用是传递电荷以维持电荷平衡,Fe3+ 经过盐桥进入左侧烧杯中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com