
【题目】实验室制备下列气体时,不能用排空气法收集的是( )
A.NH3B.CO2C.NOD.NO2
科目:高中化学 来源: 题型:
【题目】(1)把一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生;再平行地插入一块铜片(如图甲所示),可观察到铜片上____(填“有”或“没有”)气泡产生;再用导线把锌片和铜片连接起来(如图乙所示),可观察到铜片上____(填“有”或“没有”)气泡产生。
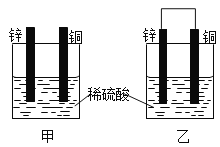
(2)图乙是一个将_____能转化为 _____能的装置,人们把它叫做原电池。外电路中的电子是从_____电极流向______电极。
(3)图乙中的电极反应式:锌片________;铜片______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予约翰·B·古迪纳、斯坦利·惠廷汉和吉野彰,以表彰他们在开发锂离子电池方面做出的卓越贡献。锂电池正极材料用到的钴酸锂(LiCoO2)属于( )
A.氧化物B.酸C.碱D.盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,制备氯乙烷(C2H5Cl)的方法有:①用乙烷与氯气反应;②用乙烯与氯化氢反应,两种方法中哪一种要更好,写出化学方程式________,该反应的类型是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子晶体的数据大小比较不正确的是( )
A. 晶格能:NaF>NaCl>NaBr
B. 硬度:MgO>CaO>BaO
C. 熔点:NaF>MgF2>AlF3
D. 阴离子的配位数:CsCl>NaCl>CaF2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某装有红色溶液的试管,加热时溶液颜色逐渐变浅,则原溶液可能是
①滴有酚酞的氨水溶液 ②滴有酚酞的氢氧化钠溶液
③溶有SO2的品红溶液 ④滴有酚酞的饱和氢氧化钙溶液
⑤酚酞溶液中滴加少量NaClO溶液
A. ①④⑤ B. ①③ C. ③④⑤ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。它易溶于水,不溶于乙醇,具有较强的还原性,可应用于照相等工业中。回答下列问题:
(1)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_________________________________________。
(2)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:

①Na2S2O3·5H2O制备原理为_________________________________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2SO3、Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________(填试剂名称),若____________(填现象),则证明产品中含有Na2SO3和Na2SO4。
③粗品中Na2S2O3·5H2O的质量分数的测定称取5g粗品配制250 mL的溶液待用。另取25.00 mL 0.0100 mol· L-1K2Cr2O7溶液于锥形瓶中,然后加入过量酸化的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL。滴定终点的现象是____________________。请写出K2Cr2O7溶液加入过量酸化的KI溶液反应的例子方程式:____________________________________________。粗品中Na2S2O3·5H2O的质量分数为_________。(已知I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列两个热化学方程式:
H2(g) + 1/2 O2(g) ![]() H2O(l) △H=-300KJ·mol-1
H2O(l) △H=-300KJ·mol-1
C3H8(g) + 5O2(g) ![]() 3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
3CO2(g) + 4H2O(l) △H =-2000.0 KJ·mol-1
实验测得氢气和丙烷的混合气体共5mol,完全燃烧时放热5000KJ,则混合气体中氢气和丙烷的体积比约为( )
A. 7:10B. 3:1C. 10:7D. 1:3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com