
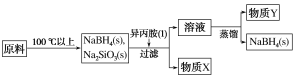
【题目】硼氢化钠(NaBH4)在有机合成中被称为“万能还原剂”,它的特点是性能稳定,还原时有选择性。采用NaBO2、SiO2、Na、H2为原料制备NaBH4的流程如图所示。
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33 ℃)。
(1)NaBH4中含有的化学键类型为____________________。
(2)制取NaBH4的化学方程式为_________________________________________________;
在该反应加料之前,需要将反应容器加热至100 ℃以上并通入氩气,通入氩气的目的是__ 。
(3)在强碱性条件下,常用NaBH4处理含Au3+的废液生成单质Au,已知,反应后硼元素以BO2形式存在,反应前后硼元素化合价不变,且无气体生成,则发生反应的离子方程式为_______ 。
(4)物质X的化学式为__________;以上流程中可以循环使用的物质是_________。
【答案】离子键、共价键 ![]() 排出反应器中的水蒸气和空气 8Au3++3BH4+24OH=8Au+3BO2+18H2O Na2SiO3 异丙胺
排出反应器中的水蒸气和空气 8Au3++3BH4+24OH=8Au+3BO2+18H2O Na2SiO3 异丙胺
【解析】
NaBO2、二氧化硅、钠和氢气加热到100℃以上生成了硼氢化钠,同时生成硅酸钠。加入异丙胺,硼氢化钠溶于异丙胺,进入到溶液中,硅酸钠不溶于异丙胺,过滤出来,即是物质X。将溶液蒸馏,把异丙胺蒸馏出去,剩下的固体即为硼氢化钠。
(1)在硼氢化钠中存在着钠离子和硼氢根离子,两种离子之间是离子键,BH4-中B和H之间是共价键。故答案为:离子键、共价键;
(2)NaBO2、二氧化硅、钠和氢气加热到100℃以上生成了硼氢化钠,同时生成硅酸钠。因为硼氢化钠能跟水发生反应且有很强的还原性,所以通入氩气,排除反应器中的水蒸汽和空气。故答案为:![]() ,排出反应器中的水蒸气和空气;
,排出反应器中的水蒸气和空气;
(3)硼氢化钠中氢是负一价,体现出很强的还原剂,把Au3+还原成单质,氢本身化合价升高,由于无气体生成,所以氢变成正一价,再根据溶液是强碱性,写出离子方程式:8Au3++3BH4+24OH=8Au↓+3BO2+18H2O;
(4)第一步反应生成硼氢化钠的同时还生成硅酸钠,硼氢化钠溶于异丙胺,而硅酸钠不溶,过滤后物质X是硅酸钠。流程最后蒸馏出去的异丙胺可以循环使用。故答案为:Na2SiO3,异丙胺。


科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

①C、D中的溶液依次为_________(填标号)。C、D中有气泡冒出,并可观察到的现象分别为_______________。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②写出硫酸亚铁高温分解反应的化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B为常见的浓酸溶液;X、Y、Z、W均为氧化物,其中X是红棕色气体,Y的固体可用于人工降雨,W既能使澄清石灰水变浑浊,又能使品红溶液褪色。根据如图所示转化关系(反应条件略),回答下列问题:
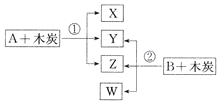
(1)Y是__________(填化学式)。
(2)将B露置在空气中一段时间,溶液质量增加但溶液浓度降低,表明B具有_____性;利用这种性质可以进行______(填字母)实验操作。
![]() 干燥二氧化硫
干燥二氧化硫 ![]() 检验
检验![]() c 干燥氨气
c 干燥氨气 ![]() 钝化铝片
钝化铝片
(3)写出X与Z的反应方程式:________________。
(4)W具有漂白性,氯水也有漂白性,两者同时使用,漂白效果将_________(填“增强”或“减弱”),原因是____________(用化学方程式表示)。
(5)反应①中氧化产物和还原产物的物质的量之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究铝片与Na2CO3溶液的反应。
| | |
无明显现象 | 铝片表面产生细小气泡 | 出现白色浑浊,产生大量气泡(经检验为H2和CO2) |
下列说法不正确的是
A. Na2CO3溶液中存在水解平衡:CO32- + H2O HCO3- + OH-
B. 对比Ⅰ、Ⅲ,说明Na2CO3溶液能破坏铝表面的保护膜
C. 推测出现白色浑浊的原因:AlO2- + HCO3- + H2O = Al(OH)3↓+ CO32-
D. 加热和H2逸出对CO32- 水解平衡移动方向的影响是相反的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,22.4 L乙烯含有的共用电子对数为5NA
B.1 mol NaHSO4中的阳离子数为2NA
C.通常状况下,1 mol NO和0.5 molO2 在密闭容器中混合,生成NO2分子数为NA
D.制取漂白粉时,标准状况下22.4 LCl2 参加反应,转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种锂电池,用金属锂和石墨作电极材料,电解质溶液是由四氯铝锂(LiAlCl4)溶解在亚硫酰氯(![]() )中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2===6LiCl+Li2SO3+2S,下列叙述中正确的是( )
A. 电解质溶液中混入水,对电池反应无影响
B. 金属锂作电池的正极,石墨作电池的负极
C. 电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3
D. 电池工作过程中,金属锂提供的电子与正极区析出的硫的物质的量之比为4∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
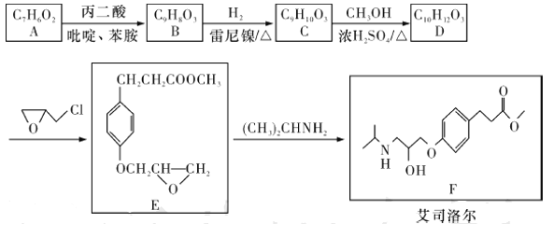
【题目】艾司洛尔是预防和治疗手术期心动过速或高血压的一种药物,艾司洛尔的一种合成路线如下:
回答下列问题:
(1)丙二酸的结构简式为___________;E中含氧官能团的名称是___________。
(2)A遇FeCl3溶液发生显色反应,1 mol A和1 mol丙二酸在吡啶、苯胺中反应生成l mol B、1 mol H2O和1 mol CO2,B能与溴水发生加成反应,推测A生成B的化学方程式为_______________________________________________________。
(3)D生成E的反应类型为_____________。
(4)已知碳原子上连有4个不同的原子或基团时,该碳称为手性碳。用星号(*)标出F中的手性碳:_______________。
(5)X是B的同分异构体,X同时满足下列条件的结构共有___________种(不考虑空间异构),其中核磁共振氢谱有五组峰的结构简式为______________。
①可与碳酸氢钠溶液反应生成二氧化碳;②遇FeCl3溶液发生显色反应;③除苯环外不含其他环。
(6)写出以苯甲醇和丙二酸为原料制备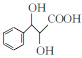 的合成路线_________________。
的合成路线_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com