
����Ŀ��̽����Ƭ��Na2CO3��Һ�ķ�Ӧ��
| | |
���������� | ��Ƭ�������ϸС���� | ���ְ�ɫ���ǣ������������ݣ�������ΪH2��CO2�� |
����˵������ȷ����
A. Na2CO3��Һ�д���ˮ��ƽ�⣺CO32- + H2O HCO3- + OH-
B. �ԱȢ�˵��Na2CO3��Һ���ƻ�������ı���Ĥ
C. �Ʋ���ְ�ɫ���ǵ�ԭ��AlO2- + HCO3- + H2O = Al(OH)3��+ CO32-
D. ���Ⱥ�H2�ݳ���CO32- ˮ��ƽ���ƶ������Ӱ�����෴��
���𰸡�D
��������
A. ��Һ��̼�����ˮ�⣬���ˮ������������ӣ�����̼�������A����ȷ�����������⣻
B��ʵ���͢�û�����ݣ�������ѧAl���Ժ���ˮ��Ӧ�����Ǵ�ʵ����û�����ݣ�˵��������Ĥ�ı�����ʵ�����ȴ�����ݣ�˵������Ĥ���ƻ���B����ȷ�����������⣻
C��Na2CO3��Һ�ʼ��ԣ���Ƭ�ڼ�����Һ����OH����Ӧ������ƫ�������2Al��2OH����2H2O=2AlO2����3H2����AlO2����HCO3-��Ӧ������������������C����ȷ�����������⣻
D��CO32����ˮ�������ȵģ����ȿ��Դٽ�ˮ�⡣H2������ԭ����Al��CO32��ˮ�����ɵ�OH����Ӧ����H2��H2�ݳ���������Al��OH���ķ�Ӧ��OH�����٣��Ӷ��ٽ�̼���ˮ�⣬���Ⱥ�H2�ݳ���CO32- ˮ��ƽ���ƶ������Ӱ������ͬ�ģ�D����������⣻
�����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯�����ڿ�ѧ�о���ҵ�����о�����Ҫ����;��
��1�����Ȼ�����Һ���ڼ���ʳ���㾫������������ʱ����������ɫ�����������ӽṹ��ͼ��ʾ��
�ٴ�������У������Ӽ۵����Ų�ͼΪ_____��
�ڴ���������̼ԭ�ӵ��ӻ��������Ϊ_____��
�۴��������к��еĻ�ѧ��Ϊ_____��
A�����Ӽ� B�������� C�����Լ� D���Ǽ��Լ� E����λ�� F����� G������ H������
��2��NO2-�������γɵ�������[Co(NO2)6]3-�����ڼ���K+�Ĵ��ڡ�NO2-���ӵ�VSEPRģ������Ϊ_____��K3[Co(NO2)6]�ǻ�ɫ������������������Ԫ�صĵ縺���ɴ�С��˳����_____��
��3���о����ʴ��Ա��������������Ӻ�δ�ɶԵ���Խ�࣬�����Խ�ż�¼����Խ�á�������������V2O5��CrO2�������ʺ���¼�����ŷ�ԭ�ϵ���_____��

��4���̵�һ�������Ļ�ѧʽΪMn(BH4)2(THF)3��д��������BH4-��Ϊ�ȵ��������_____����дһ�����Ӻ�һ�����ӣ���
��5��ZnS��ӫ���塢�����ϡ�Ϳ�ϡ����ϵ���ҵ��Ӧ�ù㷺������ZnS����Ľṹ��ͼ��ʾ��a����λ��Ϊ_____����֪�����ܶ�Ϊ�� g/cm3��������2��b��֮��ľ���Ϊ_____nm���м���ʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�������й�˵����ȷ����
A. 235g����![]() �����ѱ䷴Ӧ��
�����ѱ䷴Ӧ��![]() +
+![]()
![]()
![]() +
+![]() +10
+10![]() ������������(
������������(![]() )��Ϊ10NA
)��Ϊ10NA
B. �����£�0.5L pH=14��Ba(OH)2��Һ��OH����ĿΪNA
C. һ�������£�32gSO2������O2��Ӧ��ת�Ƶĵ�����ΪNA
D. ��״���£�5.6L�����к��еļ��Լ���ĿΪ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Bodensteins�о���ӦH2(g)��I2(g)![]() 2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
2HI(g)���¶�ΪTʱ�������������Ϊ1 L���ܱ������н���ʵ�飬������������е⻯������ʵ�������w (HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
������� | ��ʼ���� | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
I | 0.5 mol I2��0.5 mol H2 | w (HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
II | x mol HI | w (HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
�о�����������Ӧ�У�v����ka��w(H2)��w(I2)��v����kb��w2(HI)������ka��kbΪ����������˵����ȷ���ǣ�
A. �¶�ΪTʱ���÷�Ӧ![]()
B. ����I����ǰ20 min��ƽ������v(HI)=0.0125 mol��L��1��min��1
C. ����ʼʱ������I�м������ʵ�����Ϊ0.1 mol��H2��I2��HI����Ӧ�������
D. ���������д���ka��= ka����kb��= kb������x��ֵ����Ϊ�κ�ֵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NO2װ����������ܱ������У�����Ӧ2NO2(g) ![]() N2O4(g)�ﵽƽ��ı�����һ�����������������������( )
N2O4(g)�ﵽƽ��ı�����һ�����������������������( )
A. �����¶ȣ�������ɫ����������ӦΪ���ȷ�Ӧ
B. ����ѹ�����������ƽ�������ƶ������������ɫ��ԭ����
C. ����ѹ������ʹ�����Сһ�룬ѹǿ����С��ԭ��������
D. ���º���ʱ������������壬ѹǿ����ƽ�ⲻ���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ѳ������еĵ��������Ҫ��ָNO��NO2�����Ծ������������ƻ������ǻ�����������Ҫ���⡣
��1����Ư�۾���ҺΪ���ռ��ѳ������е�NO������Ȼ�ѧ����ʽ���£�
����4NO(g) + 3O2(g) + 2H2O(l) = 4HNO3(aq) H1 =��423 kJ��mol-1
����Ca(ClO)2(aq) = CaCl2(aq) + O2(g) H2 =��120 kJ��mol-1
����3Ca(ClO)2(aq) + 4NO(g) + 2H2O(l) = 4HNO3(aq) + 3CaCl2(aq) H3
�� H3 = _______kJ��mol-1 ��
�� ��Ӧ����ƽ�ⳣ�����¶����ߵı仯������________��
��2��HClO����Ч�ѳ�NO����HClO���ȶ���ʵ��Ӧ���г������Ρ�C12��Ca(OH)2��ȡƯ�۾��Ļ�ѧ����ʽ��________��
��3�����������ѳ�NO����Ҫ�������£�
a��NO+HClO = NO2+HCl
b��NO + NO2+H2O 2HNO2
c��HClO+ HNO2 = HNO3+HCl
���з�����ȷ����________��
A�������к��е�����O2�����NO���ѳ���
B��NO2��������ʱ���ܱ��ѳ�
C���ѳ������У�����������Һ��pH�½�
��4���о���ͬpH����ͬ�¶���Ư�۾���Һ��NO�ѳ��ʵ�Ӱ�죬�����ͼ1��ͼ2��
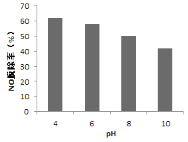

ͼ1 ͼ2
�� ͼ1�У�pH����NO�ѳ��������ԭ��________��
�� �ѳ�������������Cl2������ԭ����________�������ӷ���ʽ��ʾ����
�� ͼ2�У�60��80�� NO�ѳ����½���ԭ��________�������ٴ�����㣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.1 mo1/L CH3COONa��0.05 mo1/L HCl����������Һ������(���Ի�Ϲ���������仯)��
(1)����Һ�д���������ƽ����ϵ���õ��뷽��ʽ�����ӷ���ʽ����_______________________��_______________________��______________________��
(2)����Һ�У�Ũ��Ϊ0.05 mol/L��������_____(�����ӷ���)��c(Cl��)��c(CH3COO��)��c(CH3COOH)��������Ũ���ɴ�С�Ĺ�ϵ��__________________��
������Ũ��Ϊ0.1 mol/L�����ֵ������Һ��Na2CO3����NaHCO3����NaAlO2����CH3COONa����֪��CO2 + 3H2O + 2A1O2- = 2Al(OH)3�� + CO32-
(1)��������Һ��pH��С�����˳���ǣ�______________������)��
(2)������������Һ�зֱ����AlCl3��Һ���ܲ���������ɫ��ζ������ǣ�________������)��
(3)�������١��ڡ��ۡ���������Һ�������ʱ����һ����Һ����ܷ�����Ӧ��д���÷�Ӧ�����ӷ���ʽ��________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ÿ�������������ϴ�ӡ�����ռ���������β�����������塣��װ�ÿ����ڣ�������

A.�������������
B.����غͶ���������������
C.̼��ƺ��������ɶ�����̼
D.�Ȼ��ƺ�Ũ���������Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧʱ����Ҫ�������ʱ仯�������仯����Ҫ��ע��Ӧ�Ŀ������ȡ��ش��������⣺
(1)NH3��ԭNO����Ҫ�����������������䷴Ӧ������������ϵ����ͼ��ʾ��

����ͼ����Ϊ�ı��˷�Ӧ��������Ӧ�Ļ��b___________(���������������)a��
��������Ӧ���Ȼ�ѧ����ʽ�ɱ�ʾΪ��Ӧ�����������H��___________(��E1�� E2�Ĵ���ʽ��ʾ)
���о����֣�һ�������µ�������Ӧ���̿�����ͼ��ʾ������������ԭ��Ӧ�����ʵ����ã�NOΪ��____�������ܷ�Ӧ�Ļ�ѧ����ʽΪ��___________��
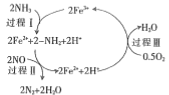
(2)һ���¶��£�����ͬ���ʵ�����H2O(g)��CO�ֱ�ͨ���ݻ�Ϊ1L�ĺ����ܱ������У����з�ӦH2O(g)+CO(g)��CO2(g)+H2(g)���õ������ʾ���������ݣ�
ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
H2O(g) | CO(g) | CO(g) | H2(g) | |||
1 | 650 | 2.0 | 4.0 | 3.0 | 1.0 | 5 |
2 | 900 | 1.0 | 2.0 | 1.8 | 0.2 | 4 |
3 | 900 | a | b | c | d | t |
��ʵ��2��4min
��650��ʱ�����ڴ������г���2.0molH2O(g)��1.0molCO(g)��1.0molCO2(g)��xmolH2(g)��Ҫʹ��Ӧ�ڿ�ʼʱ��������Ӧ������У���xӦ�����������___________��
����a=2.0��b=1.0����ƽ��ʱʵ��2��H2O(g)��ʵ��3��CO(g)��ת����(��)�Ĺ�ϵΪ��(H2O)___________(�������������=��)��(CO)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com