
【题目】已知反应:
有机物A是由乙烯和2-氯-1,3-丁二烯聚合而成的高分子,有如下转化关系: 
(1)写出下列物质的结构简式:
A、B、E。
(2)写出下列反应的化学方程式,并指明反应类型。
反应③:;
反应⑤:。
(3)化合物F是一种塑料,具有良好的生物适应性,能在自然界降解,你认为它是通过反应降解为化合物D的。
【答案】
(1)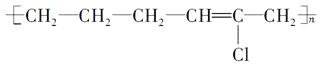 ;
;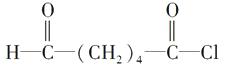 ;
;![]()
(2)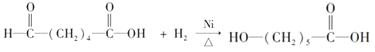 ;
;
(3)水解
【解析】根据加聚反应的规律,可推知有机物A的结构简式为 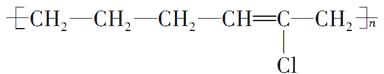 ;由题给信息反应Ⅰ可知AB时,A分子中的双键碳原子均转变为
;由题给信息反应Ⅰ可知AB时,A分子中的双键碳原子均转变为 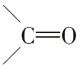 ,此时,若把A的结构写成如图所示的长键状:
,此时,若把A的结构写成如图所示的长键状: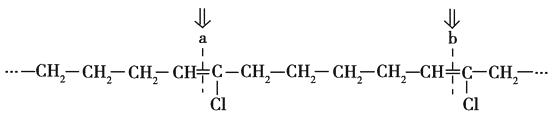
再从a、b处断键,即可迅速写出B的结构简式为 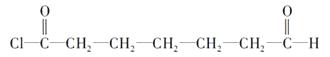 ,再由题给信息Ⅱ可推出C的结构简式为
,再由题给信息Ⅱ可推出C的结构简式为  ,而C→D是醛基上的加氢反应,则得D得结构简式为
,而C→D是醛基上的加氢反应,则得D得结构简式为  ,
,
因此E应是D发生分子内脱水反应形成的七元环酯 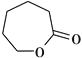 ,而F应是高聚酯,其结构简式为
,而F应是高聚酯,其结构简式为  ,通过水解可降解为D。
,通过水解可降解为D。
【考点精析】关于本题考查的聚合反应与酯化反应,需要了解聚合反应是通过加成聚合反应形成高分子化合物,特征是生成物只有高分子化合物,其组成与单体相同;酯化反应是酸与醇起作用、生成酯和水的反应才能得出正确答案.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图所示的电化学装置中,电极I为Al,其他电极均为Cu,则下列说法正确的是( )
A.电子流向:电极Ⅳ→
B.→电极I
C.电极Ⅲ的电极反应:2H2O-4e-=4H++O2↑
D.电极Ⅱ的质量减少,电极Ⅲ的质量增加
E.三个烧杯中的SO42﹣浓度都始终保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四片玻璃片上分别滴有下列溶液,当氨气靠近各玻璃片时,有白烟产生的是( )
①浓硫酸 ②浓磷酸 ③浓硝酸 ④浓盐酸
A. ①② B. ①③ C. ②③④ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密度为0.910g/cm3的氨水,质量分数为25.0%,该氨水用等体积的水稀释后,所得溶液的质量分数为
A. 等于12.5% B. 大于12.5% C. 小于12.5% D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数值,下列说法不正确的是( )
A.10 g D216O中所含中子数为5NA
B.标准状况下,22.4 L乙烷中所含共价键数目为7NA
C.7.8g Na2O2中所含阴、阳离子总数目为0.4NA
D.密闭容器中,1 mol N2和3 mol H2充分反应后,容器中的分子数一定大于2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,利用海水可以获得很多化工产品.
(1)海水中制得的氯化钠可用于生产烧碱及氯气.反应的离子方程式是 .
(2)利用制盐后的盐卤提取溴的工艺流程如下(部分操作和条件已略去): ![]()
将Br2与Na2CO3反应的化学方程式补充完整:Br2+Na2CO3═NaBrO3++
(3)盐卤蒸发冷却后析出卤块的主要成分是MgCl2 , 此外还含Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如下(部分操作和条件已略去): 
生成氢氧化物沉淀的pH
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
①步骤②中需控制pH=9.8,其目的是 .
②用NaClO 氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是 .
③步骤③需在HCl保护气中加热进行,其原理涉及的离子方程式为 .
④NaClO还能除去盐卤中的CO(NH2)2 , 生成盐类物质和能参与大气循环的物质.除去0.1mol CO(NH2)2时消耗NaClOg.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC),由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池,其工作原理如图所示,下列说法正确的是( )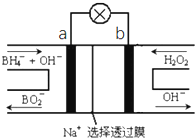
A.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4
B.电极a采用MnO2 , MnO2既作电极材料又有催化作用
C.电池放电时Na+从b极区移向a极区
D.电池的负极反应为BH4﹣+2H2O﹣8e﹣═BO2﹣+8H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀土是我国战略性资源.氟碳铈矿主要化学成分为CeFCO3 , 它是提取铈族稀土元素的重要矿物原料.关于氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下:
请回答下列问题
(1)为增大反应速率,提高原料的利用率,焙烧前可将矿石处理.
(2)焙烧过程中产生的SO3尾气常采用喷淋法净化,再用石灰乳中和;操作I中滤渣的主要成分是 .
(3)操作II若在实验室中进行,需要的主要玻璃仪器有、烧杯、玻璃棒等;所用萃取剂HT需具备的条件是 .
①HT不溶于水,也不和水反应
②Ce3+不和萃取剂HT发生反应
③Ce3+在萃取剂HT中溶解度大于水
④萃取剂HT的密度一定大于水
(4)已知有机物HT能将Ce3+从水溶液中萃取出来,该过程可表示为:2Ce3+ (水层)+6HT(有机层)2CeT3(有机层)+6H+(水层)从平衡角度解释:向CeT3 (有机层)加入稀硫酸获得较纯的含Ce3+的水溶液的原因是 .
(5)常温下,含Ce3+溶液加碱调至pH=8时,c(Ce3+)=b molL﹣1 , 已知Ce(OH)3的溶度积=a,则a和b的关系是 .
(6)写出Ce(OH)3悬浊液通入氧气得到产品的化学方程式: .
(7)取上述流程中得到的Ce(OH)4产品0.545g,加硫酸溶解后,用0.100 0molL﹣1 FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液.该产品中Ce(OH)4的质量分数为[Ce(OH)4的相对分子质量为208,结果保留两位有效数字].
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com