
【题目】过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
【答案】Ⅰ.(1)氧化性;H2O2+2Fe2++2H+=2Fe3++2H2O
(2)H2O2![]() H++HO2-;HO2-
H++HO2-;HO2-![]() H++O22-;6
H++O22-;6
Ⅱ.(3)锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色
(4)0.1800(5)偏高
【解析】
试题分析:Ⅰ.(1)酸性条件下,H2O2氧化Fe2+得到Fe3+和H2O,其反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O;体现了过氧化氢的氧化性;
(2)过氧化氢是弱电解质,H2O2溶液显酸性属于二元弱酸分部电离,电离的方程式为:H2O2![]() H++HO2- HO2-
H++HO2- HO2-![]() H++O22-;H2O2是一种二元弱酸,Ka1=1.0×10-12,则Ka1=
H++O22-;H2O2是一种二元弱酸,Ka1=1.0×10-12,则Ka1=![]() =1.0×10-12,所以c(H+)=10-6mol/L,即pH=6;
=1.0×10-12,所以c(H+)=10-6mol/L,即pH=6;
Ⅱ.(3)滴定到达终点的现象是,锥形瓶内溶液颜色恰好由无色变为浅紫色,且30秒内溶液不褪色;
(4)由于第一次数据误差过大,故舍去;其它三组的平均值为 18.00ml,根据反应2MnO4-+5H2O2+6H+═2Mn2++8H2O+5O2,n(H2O2)=2.5×n(MnO4-)=2.5×0.1000molL-1×0.018L,c(H2O2)=![]() =0.1800 mol/L;
=0.1800 mol/L;
(5)滴定前尖嘴中有气泡,导致消耗的标准液偏大,测定结果偏高。


科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2·12H2O俗称铵明矾,其性质稳定,是化学实验常用的基准试剂,借助碳酸氢铵与硫酸钠可以制备纯净的铵明矾,制备过程如下图,下面相关说法错误的是
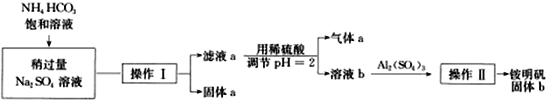
A. 为加快操作I的速率实验时采用抽滤,常用玻璃纤维替代滤纸
B. 操作I的基本过程为蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C. 使用NaOH和BaCl2试剂可以检验铵明矾的三种离子
D. 若气体a通入到饱和的纯碱溶液中会有晶体析出,该晶体与固体a相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列数量的各物质所含原子数按由大到小的顺序排列是________。
①0.5 mol氨气
②标准状况下22.4 L氦气
③4 ℃时9 mL水
④0.2 mol磷酸钠(Na3PO4)
(2)现有m g某气体,它是三原子分子,其摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为________mol。
②该气体所含原子总数为________个。
③该气体在标准状况下的体积为________L。
④该气体完全溶于水形成V L溶液(不考虑反应),所得溶液的物质的量浓度为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积等pH的盐酸和氯化铵两溶液,下列说法正确的是
A. 两溶液导电能力相同
B. 分别与适量且等量的锌反应,平均反应速率后者大
C. 分别与等浓度的氢氧化钠溶液反应至中性,消耗的氢氧化钠的体积相同
D. 稀释10倍后,盐酸的pH比氯化铵溶液的pH小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)[mol/(L·min)]表示,则正确的关系式是
A. 4v(NH3)=5v(O2) B. 5v(O2)=6v(H2O) C. 2v(NH3)=3v(H2O) D. 4v(O2)=5v(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是某同学推导“1molNa 的质量在数值上等于 Na 的相对原子质量,单位取 g”的过 程,请你补充完整。(其中 m(Na 原子)表示一个 Na 原子的质量,m(12C)表示一个 12C原子的质量 ,Ar 表示 Na 的相对原子质量,NA 表示阿伏加德罗常数)
因为:m(Na 原子)=1/12m(12C)Ar,所以:1molNa 原子的质量=1/12________Ar=1/12_____ Ar=Ar g
(2)由 CO2 与 CO 组成的混合气体对 H2 的相对密度 20,则混合气体中 CO2 的体积分数为_____,CO 的质量分数_______
(3)标准状况下,336L 的 NH3 溶于 1L 水中,若该溶液的密度为 ag/cm3,则其物质的量浓度为。将上述氨水全部转化为 NH4CL,所需 2mol/L 的盐酸的体积为_____(NH3+HCl=NH4Cl)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠样品含有少量的Na2SO4 和 Na2CO3,按下列流程进行净化,请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称:______,______,______,______,______,______,______。
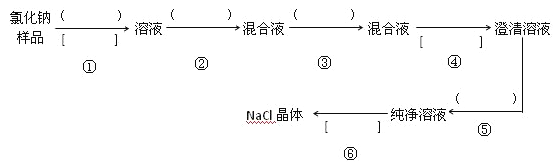
写出有关反应的化学方程式:
第②步:______________________, _________________________。
第③步:______________________。
第⑤步:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两元素为同一周期ⅡA族和ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为:( )
①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32
A.②④⑥B.①③⑥C.①②③④D.①③⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com