
【题目】(1)下面是某同学推导“1molNa 的质量在数值上等于 Na 的相对原子质量,单位取 g”的过 程,请你补充完整。(其中 m(Na 原子)表示一个 Na 原子的质量,m(12C)表示一个 12C原子的质量 ,Ar 表示 Na 的相对原子质量,NA 表示阿伏加德罗常数)
因为:m(Na 原子)=1/12m(12C)Ar,所以:1molNa 原子的质量=1/12________Ar=1/12_____ Ar=Ar g
(2)由 CO2 与 CO 组成的混合气体对 H2 的相对密度 20,则混合气体中 CO2 的体积分数为_____,CO 的质量分数_______
(3)标准状况下,336L 的 NH3 溶于 1L 水中,若该溶液的密度为 ag/cm3,则其物质的量浓度为。将上述氨水全部转化为 NH4CL,所需 2mol/L 的盐酸的体积为_____(NH3+HCl=NH4Cl)。
【答案】6.02×1023m(12C)12g75%17.5%336000a/(22400+5712)mol/L 7.5L
【解析】
(1)因为m(Na 原子)=1/12m(12C)Ar,所以1molNa 原子的质量=(1/12)×6.02×1023×m (12C)Ar=(1/12)×12gAr=Ar g;综上所述,本题答案是:6.02×1023m(12C);12g。
(2)根据ρ1/ρ2=M1/M2=d(相对密度)可知,混合气体的平均分子量=20×2=40;设CO2 和CO物质的量分别为x 、y,则(44x+28y)/(x+y)=40,解之得x=3,y=1;则混合气体中 CO2 的体积分数为3/(3+1)×100%=75%;CO 的质量分数为(1×28)/(1×28+3×44)×100%=17.5%;因此本题答案是:75%;17.5%。
(3)氨水中氨的质量分数ω=(17×336/22.4)/(17×336/22.4+1000)×100%;根据公式c=![]() ,带入数值,c=1000×a×ω/17=336000a/(22400+5712)mol/L;n(NH3)=n(HCl),所以n(HCl)=n(NH3)=336/22.4=15mol,根据c=n/V可知,所需2mol/L 的盐酸的体积V=15/2=7.5L;综上所述,本题答案是:336000a/(22400+5712) mol/L,7.5L。
,带入数值,c=1000×a×ω/17=336000a/(22400+5712)mol/L;n(NH3)=n(HCl),所以n(HCl)=n(NH3)=336/22.4=15mol,根据c=n/V可知,所需2mol/L 的盐酸的体积V=15/2=7.5L;综上所述,本题答案是:336000a/(22400+5712) mol/L,7.5L。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:
【题目】①已知t℃时AgCI的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCI和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢其水溶液适用于医用伤口消毒及环境消毒和食品消毒。
Ⅰ.过氧化氢性质实验
(1)酸性条件下H2O2可将水中的Fe2+转化成Fe3+,由此说明H2O2具有___________性。请写出该反应离子方程式: 。
(2)已知H2O2是一种二元弱酸,其中Ka1=1.0×10-12、Ka2=1.05×10-25;则H2O2的电离方程式为 ,常温下1mol·L-1的H2O2溶液的pH为 。
Ⅱ.过氧化氢含量的实验测定
兴趣小组同学用0.1000 mol·L-1酸性高锰酸钾标准溶液滴定试样中过氧化氢的含量,反应原理为:2MnO![]() +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
(3)滴定到达终点的现象是____________________。
(4)用移液管吸取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗的KMnO4标准溶液体积如下表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
体积(mL) | 17.10 | 18.10 | 18.00 | 17.90 |
计算试样中过氧化氢的浓度为__________mol·L-1。
(5)若滴定前尖嘴中有气泡,滴定后消失,则测定结果________(“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 某原子的摩尔质量是Mgmol-1,则一个该原子的真实质量为![]() g
g
B. 氢氧化钠的摩尔质量为40g
C. 1 mol氧原子的质量就是氧的相对原子质量
D. H2SO4的摩尔质量为96g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知有机物A是一种重要的化工原料,转化关系如下图:
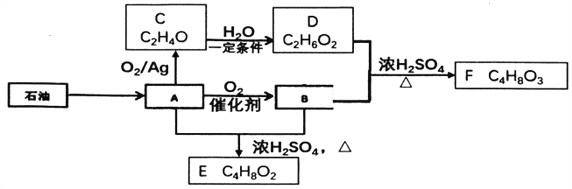
已知:同一碳原子上连接2个或2个以上-OH是不稳定结构,E能发生水解反应
请回答:
(1)A中官能团名称________。
(2)有机物C的结构简式________。
(3)B+D-F的化学方程式是________。
(4)已知![]() 能按下图方式进行裂解:
能按下图方式进行裂解:
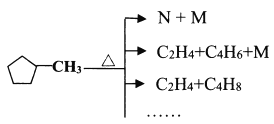
下列说法不正确的是________。
A.可用溴水区分![]() 和N
和N
B.E和![]() 都可以使酸性KMnO4褪色
都可以使酸性KMnO4褪色
C.等质量的A和![]() 完全燃烧时的耗氧量相同
完全燃烧时的耗氧量相同
D.N(五元环)可能的结构有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3X(g)+Y(g) ![]() Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
Z(g),在其他条件不变时,改变其中一个条件,则生成Z的速率(填“增大”“减小”或“不变”):
(1)升高温度:____________;
(2)增大压强:____________;
(3)增大容器容积:______________;
(4)加入X:______________;
(5)加入Y:______________;
(6)压缩体积:______________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于平衡常数的说法正确的是
A. 在平衡常数表达式中,反应物浓度用起始浓度表示,生成物浓度用平衡浓度表示
B. 可逆反应中,反应物的转化率增大,一定导致化学平衡常数增大
C. 可以用化学平衡常数来定量描述化学反应的限度
D. 平衡常数的大小与温度、浓度、压强、催化剂有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的液态化合物XY2,在一定量的O2中恰好完全燃烧,反应方程式为XY2(l)+3O2(g)﹦XO2(g)+2YO2(g),冷却后,在标准状况下测得生成物的体积是672 mL,密度是2.56 g·L-1。
(1)反应前O2的体积是________mL(标准状况下)。
(2)化合物XY2的摩尔质量是________。
(3)若XY2分子中X、Y两元素质量比是3:16,则X、Y两元素分别是________和________(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com