
【题目】一种电解法制备高纯铬和硫酸的简单装置如图所示。下列说法正确的是
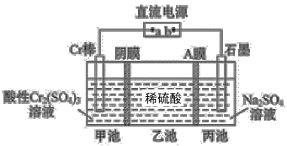
A.b为直流电源的负极
B.阴极反应式为2H++2e-=H2↑
C.工作时,乙池中溶液的pH减小
D.若有1mol离子通过A膜,理论上阳极生成5.6mL气体
【答案】C
【解析】
该装置制备高纯Cr和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,阴极电极反应式为Cr3++3e-=Cr;阳极电极反应式为2H2O-4e-=O2↑+4H+,从而实现目的,据此分析解答。
A. 该装置制备高纯Cr和硫酸,甲池中Cr电极上Cr3+得电子发生还原反应,则Cr为阴极,连接阴极的电极a为负极,则b为正极,A项错误;
B. 阴极反应式为Cr3++3e-=Cr;阳极反应式为2H2O4e=O2↑+4H+,B项错误;
C. 甲池中硫酸根离子通过交换膜进入乙池、丙中生成的氢离子通过交换膜进入乙池,所以导致乙池中硫酸浓度增大,溶液的pH减小,C项正确;
D. 若有1 mol离子通过A膜,则丙池生成1mol氢离子,根据氢离子和氧气关系知,理论上阳极生成气体0.25mol,但没有指明为标准状况,不能计算氧气的体积,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数分别为Kal(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.H2SO4在冰醋酸中的电离方程式为H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B.H2SO4在冰醋酸中:![]() =c(HSO4-)+2c(SO42-)+c(CH3COO-)
=c(HSO4-)+2c(SO42-)+c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, 的值减小
的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
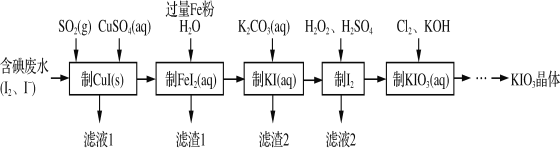
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铃兰醛[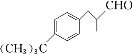 ]具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰等东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如图所示:
]具有甜润的百合香味,对皮肤的刺激性小,对碱稳定,广泛用于百合、丁香、玉兰、茶花以及素心兰等东方型香型日用香精的合成。常用作肥皂、洗涤剂的香料,还可用作花香型化妆品的香料。其合成路线如图所示:
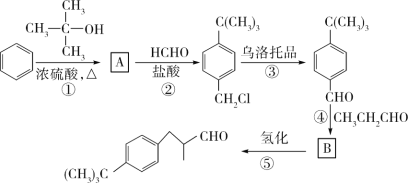
(1)B中官能团的名称是______。
(2)①的反应类型是______。
(3)写出反应②的化学方程式:______。
(4)乌洛托品的结构简式如图所示:
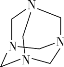
其二氯取代物有______种,将甲醛的水溶液与氨水混合蒸发可制得乌洛托品,该反应的化学方程式是______。
(5)写出满足下列条件的A的同分异构体______。
Ⅰ.有两个取代基 Ⅱ.取代基在邻位
(6)已知:RCH2COOH![]() RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸
RCHClCOOH。仿照上述流程,写出以CH3CH2CHO为原料制备聚乳酸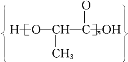 的合成路线______(无机试剂自选)。
的合成路线______(无机试剂自选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大,A、B、C、D、E均是由上述元素组成的中学化学常见的物质,其中A是单质,C是酸性氧化物,A的水溶液和C均具有漂白性,B是自然界最常见的液体,E是三元化合物,物质之间存在如图所示的关系。下列说法错误的是
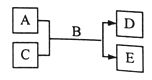
A.简单离子半径大小关系:Y>Z>X>WB.图示反应中有离子键的形成
C.简单阴离子的还原性:Y>ZD.D的水溶液中含有阴、阳离子及共价键形成的分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为![]() 的恒容密闭容器中充入
的恒容密闭容器中充入![]() 和
和![]() ,发生反应
,发生反应![]()
![]()
![]()
![]() ,测得
,测得![]() 随时间的变化如图曲线Ⅰ所示。下列说法正确的是
随时间的变化如图曲线Ⅰ所示。下列说法正确的是![]()
![]()

A.![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.保持温度不变,若起始时向上述容器中充入![]() 和
和![]() ,则平衡时
,则平衡时![]() 的体积分数为
的体积分数为![]()
C.保持温度不变,若起始时向上述容器中充入![]() 、
、![]() 、
、![]() 和
和![]() ,则此时反应正向进行
,则此时反应正向进行
D.改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.计算下列溶液的pH值(25 ℃),(请写出计算过程)将20mL0.01 mol·L-1 KOH溶液与30mL0.005mol·L-1H2SO4溶液混合并加水至100ml.
(1)求KOH溶液的pH值_______________;
(2)求H2SO4溶液的pH值_______________;
(3)求混合液的pH值_______________。
II.将10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH(酸)与强碱的pH(碱)之间应满足的关系__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置制取氨气并探究氨气的有关性质。

(1)装置A中烧瓶内试剂可选用_______(填序号)。
a.碱石灰 b.浓硫酸 c.生石灰 d.五氧化二磷 e.烧碱固体
(2)若探究氨气的溶解性,需在K2的导管末端连接下表装置中的_____(填序号)装置,当装置D中集满氨气后,关闭K1、K2,打开K3,引发喷泉的实验操作是________。
备选装置(其中水中含酚酞溶液) | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
(3)若探究氨气的还原性,需打开K1、K3,K,2处导管连接制取纯净、干燥氯气的装置。
①用二氧化锰与浓盐酸制取氯气生成气体必须通过盛有_____试剂的洗气瓶;
②D中氨气与氯气反应产生白烟,同时生成一种无色无味的气体,该反应的化学方程式为_________。
③从K3处导管逸出的气体中含有少量C12,则C装置中应盛放_____溶液(填化学式),反应的离子方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
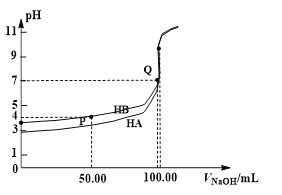
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com