
【题目】由含碘废水制取碘酸钾的一种工艺如下:
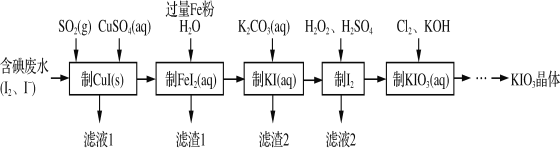
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
【答案】食盐添加剂,补充碘成分,预防碘缺乏病 淀粉溶液 SO2+I2+2H2O=SO42-+2I-+4H+( 或2SO2+I2+2Cu2++4H2O=2CuI↓+2 SO42-+8H+) KI(aq) 6.0 5Cl2+I2+12OH-=2IO3-+10Cl-+6H2O 蒸发浓缩,降温结晶
【解析】
含碘废水制取碘酸钾晶体,由实验流程可知,含碘废水中加入SO2和硫酸铜制备CuI,发生2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+,滤液1含硫酸,过滤得到滤渣中加入铁粉、水制备FeI2,过滤得到滤渣1中含有Fe和Cu,滤液中加入碳酸钾制备KI,发生K2CO3+FeI2=FeCO3↓+2KI,滤渣2为FeCO3;酸性条件下KI、过氧化氢发生氧化还原反应生成碘,滤液2含硫酸钾,然后碘、氯气、KOH发生5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O制备碘酸钾,结合溶解度曲线和物质的性质分析解答。
⑴ KIO3是日常生活中食用加碘盐的主要添加剂,可以预防碘缺乏病,故答案为:食盐添加剂,补充碘成分,预防碘缺乏病;
(2)因淀粉遇碘变蓝,因此检验“含碘废水”中是否含有单质I2,常用的试剂是淀粉溶液,故答案为:淀粉溶液;
(3)通入SO2的目的是将I2还原为I-,二氧化硫被氧化生成硫酸,反应的离子方程式为SO2+I2+2H2O═SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+),故答案为:SO2+I2+2H2O═SO42-+2I-+4H+(或2SO2+I2+2Cu2++4H2O═2CuI↓+2SO42-+8H+);
⑷ 根据工艺流程图,五种物质的制备反应中,只有制备KI溶液的过程中没有元素化合价的变化,不涉及氧化还原反应,故答案为:KI(aq);
(5)Ksp[Fe(OH)2]=9.0×10-15,现测得溶液中c(FeI2)为0.9 molL-1,则c(OH-)=![]() =10-7mol/L,此温度下,Kw=1.0×10-13,c(H+)=
=10-7mol/L,此温度下,Kw=1.0×10-13,c(H+)=![]() =10-6mol/L,pH=-lg10-6=6.0,故答案为:6.0;
=10-6mol/L,pH=-lg10-6=6.0,故答案为:6.0;
(6)“制KIO3溶液”时,氯气和碘单质与氢氧化钾溶液反应生成KIO3和氯化钾,反应的离子方程式为5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O,故答案为:5Cl2+I2+12OH-═2IO3-+10Cl-+6H2O;
(7)由溶解度曲线图可知,KIO3的溶解度小于KCl且KIO3的溶解度随温度升高而增大,由KIO3溶液得到KIO3晶体,可以通过蒸发浓缩、降温结晶的方法得到,故答案为:蒸发浓缩、降温结晶。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,我们不了解它们的化学式,但它们在一定条件下有下列转化关系(未配平,且四个反应均为氧化还原反应):
①G→Q+NaCl ②Q+H2O![]() X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
X+H2↑ ③Y+NaOH→G+Q+H2O ④Z+NaOH→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、XB. X、Z、Q、G、Y
C. X、Z、Q、Y、GD. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

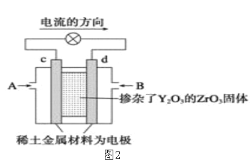
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种合成囧烷(E)的路线如下:

⑴ A中所含官能团的名称是_______________;E的分子式为_________。
⑵ A→B、B→C的反应类型分别是___________、___________。
⑶ 在一定条件下,B与足量乙酸可发生酯化反应,其化学方程式为______________。
⑷ F是一种芳香族化合物,能同时满足下列条件的F的同分异构体有_____种。
① 1个F分子比1个C分子少两个氢原子
② 苯环上有3个取代基
③ 1molF能与2molNaOH反应
写出其中核磁共振氢谱图有5组峰,且面积比为3∶2∶2∶2∶1的一种物质的结构简式:__________。
⑸ 1,2-环己二醇(  )是一种重要的有机合成原料,请参照题中的合成路线,以
)是一种重要的有机合成原料,请参照题中的合成路线,以 和
和![]() 为主要原料,设计合成1,2-环己二醇的合成路线。______________
为主要原料,设计合成1,2-环己二醇的合成路线。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置探究草酸钙晶体(![]() )的热分解。已知:CO能与
)的热分解。已知:CO能与![]() 溶液反应生成黑色的钯粉。
溶液反应生成黑色的钯粉。

(1)A的作用是____________________;D中可观察到的现象是_________________。
(2)B中长玻璃管的作用是______________________________________________。
(3)E、F位置___________(填“能”或“不能”)互换,理由是________________________________。
(4)写出![]() 溶液与CO反应的化学方程式_______________________________________________。
溶液与CO反应的化学方程式_______________________________________________。
(5)为探究草酸钙晶体加热分解产物的成份并测x,进行如下实验:
①按上图连接好仪器,______________________________(填实验操作名称)。
②将29.2g草酸钙晶体放入C中,从a处通入一段时间空气。
③加热草酸钙晶体直到质量不再减少,从a处一直通空气直至冷却。
④测得C中残留固体质量11.2g,D增重3.6g,E增重8.8g(澄清石灰水足量)。
⑤数据处理:计算可得x=_______________;写出上述实验中草酸钙晶体受热分解的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:

(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒,乙池中的________棒。
②乙池中阳极的电极反应式是__________________________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式_______________________________。
②甲池中碳极上电极反应式是____________________________,乙池碳极上电极反应属于______________(填“氧化反应”或“还原反应”)。
③将湿润的KI淀粉试纸放在乙池碳极附近,发现试纸变蓝,反应的化学方程式为________________________________________。
④若乙池转移0.02 mol e-后停止实验,池中电解质溶液体积是200 mL,则溶液混合均匀后的c(OH—)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列化学反应中,所断裂的共价键中,仅仅断裂δ键的是 ( )
A. N2+3H2  2NH3
2NH3
B. 2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
C. Cl2+H2![]() 2HCl
2HCl
D. C2H4+H2![]() C2H6
C2H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com