
【题目】在下列化学反应中,所断裂的共价键中,仅仅断裂δ键的是 ( )
A. N2+3H2  2NH3
2NH3
B. 2C2H2+5O2![]() 2H2O+4CO2
2H2O+4CO2
C. Cl2+H2![]() 2HCl
2HCl
D. C2H4+H2![]() C2H6
C2H6
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
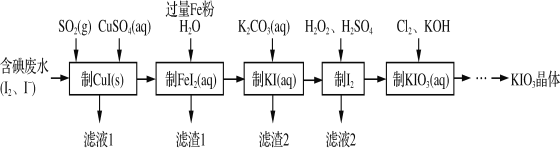
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)

下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO)>c(H+)>c(Na+)>c(OH)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某学生用 0.100 mol·L-1 的 KOH 标准溶液滴定未知浓度的盐酸, 其操作可分解为如下几步:
A.移取 20.00 mL 待测盐酸溶液注入洁净的锥形瓶,并加入 2~3 滴酚酞;
B. 用 标 准 溶 液 润 洗 滴 定 管 2~3次 ;
C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准 KOH 溶液注入碱式滴定管至刻度“0”以上 2~3 mL; E.调节液面至“0”或“0”以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准 KOH 溶液滴定至终点并记下滴定管液面的刻度。
就此实验完成填空:
(1)正确操作步骤的顺序是(用字母序号填写)_____。
(2)上述 A 步骤操作之前,若先用待测溶液润洗锥形瓶,则滴定结果_________(填“偏高”“偏低”或“不变”)。
(3)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果_____(填“偏高”“偏低”或“不变”)。
Ⅱ.测血钙的含量时,可将 2.0 mL 血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4 晶体,反应生成 CaC2O4 沉淀。将沉淀用稀硫酸处理得 H2C2O4 后,再用酸性 KMnO4 溶液滴定,氧化产物为 CO2,还原产物为 Mn2+,若终点时用去 20.00 mL 1.0×10-4 mol·L-1 的 KMnO4 溶液。
(1)写出用 KMnO4 滴定 H2C2O4 的离子方程式_____________。
(2)判断滴定终点的方法是_________。
(3)计算:血液中含钙离子的浓度为_____g·mL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,从精制黑钨矿(FeWO4、MnWO4)中提取金属钨的一种流程如下图所示,该流程同时获取副产物Fe2O3和MnCl2。

已知:I.过程①~④中,钨的化合价均不变;
Ⅱ.常温下钨酸难溶于水;
Ⅲ.25℃时,Ksp[Fe(OH)3]=1.0×10-38,Ksp [Mn(OH)2]=4.0×10-14
回答下列问题:
(1)上述流程中的“滤渣1”除MnO2外还有_____、“气体”除水蒸气、HCl外还有____(均填化学式);
(2)过程①中MnWO4参与反应的化学方程式为______;FeWO4参与的反应中氧化剂与还原剂的物质的量之比为___________;
(3)已知WO3(s)+3H2(g)=W(s)+3H2O(g) ΔH=a kJ·mol-1
WO3(s)=WO3(g) ΔH=b kJ·mol-1
写出WO3(g)与H2(g)反应生成W(s)的热化学方程式:_______;
(4)过程⑦在25℃时调pH,至少应调至_______(当离子浓度等于1.0×10-5mol·L-1时,可认为其已沉淀完全);
(5)过程⑧要获得MnCl2固体,在加热时必须同时采取的一项措施是__________;
(6)钠钨青铜是一类特殊的非化学计量比化合物,其通式为NaxWO3,其中0<x<1,这类化合物具有特殊的物理化学性质,是一种低温超导体。应用惰性电极电解熔融的Na2WO4和WO2混合物可以制备钠钨青铜,写出WO42-在阴极上放电的电极反应式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A,B,C分别代表三种不同的短周期元素,A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍。
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于__键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是__;
(2)当n=2时,B与C形成的晶体属于__晶体,当n=3时,B与C形成的晶体中,B原子的杂化方式为__,微粒间的作用力是__;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物。
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4],CO分子中C原子上有一对孤对电子,C,O原子都符合8电子稳定结构,CO的结构式为__,与CO互为等电子体的离子为__(填化学式)。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,镓的基态原子的电子排布式是_______________,Ga的第一电离能却明显低于Zn,原因是_____________________。
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是__。
a.直线形;三角锥形 b.V形;三角锥形 c.直线形;平面三角形 d.V形;平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分散系的叙述不正确的是
A. 分散系的分类:![]()
B. 用平行光照射FeCl3溶液和Fe(OH)3胶体,可以加以区分
C. 把FeCl3饱和溶液滴入到蒸馏水中,以制取Fe(OH)3胶体
D. 如图所示是树林中的晨曙,该反应与丁达尔效应有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O![]() Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com