
【题目】某研究性学习小组利用下图装置探究草酸钙晶体(![]() )的热分解。已知:CO能与
)的热分解。已知:CO能与![]() 溶液反应生成黑色的钯粉。
溶液反应生成黑色的钯粉。

(1)A的作用是____________________;D中可观察到的现象是_________________。
(2)B中长玻璃管的作用是______________________________________________。
(3)E、F位置___________(填“能”或“不能”)互换,理由是________________________________。
(4)写出![]() 溶液与CO反应的化学方程式_______________________________________________。
溶液与CO反应的化学方程式_______________________________________________。
(5)为探究草酸钙晶体加热分解产物的成份并测x,进行如下实验:
①按上图连接好仪器,______________________________(填实验操作名称)。
②将29.2g草酸钙晶体放入C中,从a处通入一段时间空气。
③加热草酸钙晶体直到质量不再减少,从a处一直通空气直至冷却。
④测得C中残留固体质量11.2g,D增重3.6g,E增重8.8g(澄清石灰水足量)。
⑤数据处理:计算可得x=_______________;写出上述实验中草酸钙晶体受热分解的化学方程式________________________________________________。
【答案】除去空气中的CO2 ,防止对分解产物的检验产生干扰 无水CuSO4变蓝 平衡气压(合理答案均计分) 不能 若互换则原F中可能产生的CO2 对原E中CO2 的检验会造成干扰 ![]() 检查装置气密性 1
检查装置气密性 1 ![]()
【解析】
加热草酸钙晶体产物可能有CO、CO2和水,为了防止空气中的CO2 和水对分解产物的检验产生干扰,需要对空气预处理;根据无水硫酸铜遇水变蓝,可用检验H2O的存在;CO2通入石灰水变浑浊,可用石灰水检验CO2;由题目提供的信息可知CO能与PdCl2溶液反应生成黑色的钯粉,可用PdCl2溶液检验CO。据此解答。
(1)空气中含有二氧化碳,利用氢氧化钠吸收二氧化碳,除去空气中的CO2,防止对分解产物的检验产生干扰;装置D中的无水硫酸铜遇水变蓝,可用检验H2O的存在;
(2)装置B中长玻璃管与外界相通,其作用是平衡气压;
(3)若互换则原F中可能产生的CO2,对原E中CO2的检验会造成干扰,所以不能互换;
(4)由题目提供的信息可知CO能与PdCl2溶液反应生成黑色的钯粉,可知PdCl2把CO氧化为CO2,反应的方程式为![]() ;
;
(5)①连接好仪器,需要检查装置气密性;
⑤残留固体质量11.2g,说明生成CaO11.2g,n(CaO)=![]() =0.2mol,D增重3.6g,说明生成H2O3.6g,n(H2O)=
=0.2mol,D增重3.6g,说明生成H2O3.6g,n(H2O)=![]() =0.2mol,E增重8.8g(澄清石灰水足量),说明生成CO28.8g,n(CO2)=
=0.2mol,E增重8.8g(澄清石灰水足量),说明生成CO28.8g,n(CO2)=![]() =0.2mol,m(CO)=29.2g-11.2g-3.6g-8.8g=5.6g,n(CO)=
=0.2mol,m(CO)=29.2g-11.2g-3.6g-8.8g=5.6g,n(CO)=![]() =0.2mol,生成
=0.2mol,生成![]() 物质的量之比为1:1:1:1,所以x为1。根据以上分析可知反应的方程式为
物质的量之比为1:1:1:1,所以x为1。根据以上分析可知反应的方程式为![]() 。
。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】盐酸吡酮洛芬(H)是一种消炎镇痛药,其合成路线如下:

已知R-CN![]() R-COOH
R-COOH
回答下列问题:
(1)A的化学名称是____。
(2)由B生成C的化学方程式为________。
(3)D的结构简式为_______。
(4)F中官能团的名称为_____。
(5)G生成H(试剂X的分子式为C6H8N2)的反应类型是____。
(6)E的分子式为____。X与E互为同分异构体,X的分子中含两个苯环,X水解后产物之一既能发生银镜反应又能与FeCl3溶液发生显色反应,X的核磁共振氢谱显示有6种不同化学环境的氢,峰面积之比为1:2:2:2:2:3。写出符合条件的X的结构简式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的![]() 与pH变化的关系如图所示.下列叙述正确的是
与pH变化的关系如图所示.下列叙述正确的是
A. M线表示![]() 随pH的变化B. BR溶液呈碱性
随pH的变化B. BR溶液呈碱性
C. 若温度升高,两条线均向上平移D. 常温下,0.1mol·L-1NaR溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:
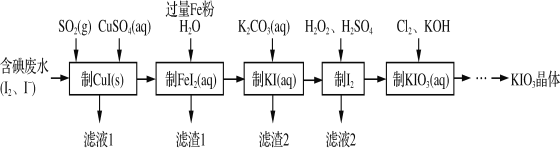
⑴ 写出KIO3在日常生活中的一个重要应用________________________。
⑵ 检验“含碘废水”中是否含有单质I2的常用试剂是________(写试剂名称)。
⑶ 通入SO2的目的是将I2还原为I-,该反应的离子方程式为______________________。
⑷ 工艺中五种物质的制备反应中,不涉及氧化还原反应的步骤是“制________”。
⑸ “制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。
为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
⑹ “制KIO3溶液”反应的离子方程式为__________________。

⑺ KCl、KIO3的溶解度曲线如图所示。流程中由“KIO3(aq)”得到KIO3晶体的操作步骤为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:______________________,该反应中,Na2O2的作用为____________(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)Na2O2与CO2反应可以产生氧气。某同学通过下列装置验证Na2O2能否与CO2反应。 (图中铁架台等装置已略去)。

①装置A的名称是_________,A中的固体为_______________,装置B中试剂的作用为__________________________
②若Na2O2能与CO2,则装置C中的现象是_____________________________
(3)碱石灰是干燥剂,在a处收集气体,检测发现该气体中几乎都是CO2气体(过氧化钠足量),则说明过氧化钠与CO2气体不反应。该同学查阅相关文献,然后撤掉装置B,其他都保留(包括试剂),连接好装置后再次进行实验,重新收集气体检测,发现得到的气体几乎都是氧气,该实验结果说明过氧化钠与CO2气体反应需要_______________。
(4)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)__________(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_____________、丙____________;
(2)写出下列反应的化学方程式;
反应①_________________________________________________________________;
反应③_________________________________________________________________;
反应⑤_________________________________________________________________;
(3)向F的溶液中加入D溶液后产生的现象是________________________________,并用化学反应方程式解释产生此现象的原因____________________、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氨水中存在下列电离平衡:NH3·H2O![]()
![]() +OH-,下列情况能引起电离平衡向逆向移动的有( )
+OH-,下列情况能引起电离平衡向逆向移动的有( )
① 加NH4Cl固体 ② 加NaOH溶液 ③ 通HCl ④ 加CH3COOH溶液 ⑤ 加AlCl3固体
A. ① ② B. ① ③ ⑤ C. ③ ④ ⑤ D. ① ② ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关阿伏加德罗常数(NA)的说法错误的是( )
A. 32gO2所含的原子数目为NA
B. 0.5molH2O含有的原子数目为1.5NA
C. 1molH2O含有的H2O分子数目为NA
D. 0.5NA个CO2的物质的量是0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A,B,C分别代表三种不同的短周期元素,A原子的最外层电子排布为ns1,B原子的价电子排布为ns2np2,C原子的最外层电子数是其电子层数的3倍。
(1)若A原子的最外层电子排布为1s1,则按原子轨道的重迭方式判断,A与C形成的化合物中的共价键类型属于__键,A与C所形成的化合物的熔沸点明显高于A与C的同主族元素所形成的化合物的熔沸点,其原因是__;
(2)当n=2时,B与C形成的晶体属于__晶体,当n=3时,B与C形成的晶体中,B原子的杂化方式为__,微粒间的作用力是__;
Ⅱ.元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.第四周期过渡元素的明显特征是形成多种多样的配合物。
(3)CO可以和很多过渡金属形成配合物,如羰基铁[Fe(CO)5]、羰基镍[Ni(CO)4],CO分子中C原子上有一对孤对电子,C,O原子都符合8电子稳定结构,CO的结构式为__,与CO互为等电子体的离子为__(填化学式)。
(4)第四周期元素的第一电离能随原子序数的增大,总趋势是逐渐增大的,镓的基态原子的电子排布式是_______________,Ga的第一电离能却明显低于Zn,原因是_____________________。
(5)用价层电子对互斥理论预测H2Se和BBr3的立体结构,两个结论都正确的是__。
a.直线形;三角锥形 b.V形;三角锥形 c.直线形;平面三角形 d.V形;平面三角形
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com