
【题目】常温下,向1L1nol/L某一元酸HR溶液中滴加一元碱BOH溶液,混合溶液的![]() 与pH变化的关系如图所示.下列叙述正确的是
与pH变化的关系如图所示.下列叙述正确的是
A. M线表示![]() 随pH的变化B. BR溶液呈碱性
随pH的变化B. BR溶液呈碱性
C. 若温度升高,两条线均向上平移D. 常温下,0.1mol·L-1NaR溶液的pH=10
【答案】C
【解析】
A.对于一元酸HR![]() H++R-,当温度不变时,Ka=
H++R-,当温度不变时,Ka=![]() 不变;pH越大,c(H+)越小,则
不变;pH越大,c(H+)越小,则![]() 越大,则
越大,则![]() 越大,对比图像可知应为N曲线表示
越大,对比图像可知应为N曲线表示![]() 随pH的变化,故A错误;
随pH的变化,故A错误;
取N曲线上的任意一点,如pH=5时,c(H+)=10-5mol/L;lg![]() =0,
=0,![]() =1;Ka=10-5。
=1;Ka=10-5。
B.曲线M为lg![]() 与pH变化的关系图,取曲线M上的一点计算,如pH=8时,c(OH-)=10-6mol/L; lg
与pH变化的关系图,取曲线M上的一点计算,如pH=8时,c(OH-)=10-6mol/L; lg![]() =0;Kb=10-6;由于Kb<Ka,B+水解程度大于R-,所以BR溶液呈酸性,故B错误;
=0;Kb=10-6;由于Kb<Ka,B+水解程度大于R-,所以BR溶液呈酸性,故B错误;
C.温度升高时,酸碱的电离程度都会变大,![]() 、
、![]() 都变大,故二条线都会上升,C正确;
都变大,故二条线都会上升,C正确;
D.对于NaR溶液: R-+H2O![]() HR+OH-
HR+OH-
起始: 0.1 0 0
平衡: 0.1-x![]() 0.1 x x
0.1 x x
水解常数K=![]() =10-9;
=10-9;![]() =10-9,计算可得x=10-5mol/L,c(H+)=10-9mol/L,pH=9,故D错误。答案选C。
=10-9,计算可得x=10-5mol/L,c(H+)=10-9mol/L,pH=9,故D错误。答案选C。


科目:高中化学 来源: 题型:
【题目】已知:四甲基氢氧化铵[(CH3)4NOH ]是强碱,甲胺 (CH3NH2H2O)为弱碱。常温下,在体积均为20 mL、浓度均为0.1 mol/L的四甲基氢氧化铵溶液和甲胺溶液中,分别滴加浓度为0.1 mol/L的盐酸,溶液的导电率与盐酸体积的关系如图所示。下列说法正确的是

A. pH的相对大小: c>d
B. 在b、c、e三点中,水的电离程度最大的点是e
C. b 点溶液:c(H+)+c(CH3NH3+) = c(OH-)
D. c 点溶液:c(Cl-)>c(CH3NH3+) >c(H+) >c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,Z与W同周期且相邻,W原子的最外层电子数与最内层电子数相等;X、Y的单质是空气中的主要成分,在放电或高温作用下化合成无色气体。下列说法正确的是
A. X和Y的单质均不存在同素异形体
B. 简单离子半径:W>X>Z>Y
C. 化合物![]() 溶于水生成碱性气体
溶于水生成碱性气体
D. 工业上常用电解熔融W的氧化物的方法制备W的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原电池原理,回答下列问题:

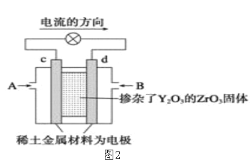
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) ![]() Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
Ca2+(aq) + 2OH-(aq),加入下列固体物质,可使Ca(OH)2固体减少的是( )
A. CaCl2 B. NaHCO3 C. NaOH D. NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下图装置探究草酸钙晶体(![]() )的热分解。已知:CO能与
)的热分解。已知:CO能与![]() 溶液反应生成黑色的钯粉。
溶液反应生成黑色的钯粉。

(1)A的作用是____________________;D中可观察到的现象是_________________。
(2)B中长玻璃管的作用是______________________________________________。
(3)E、F位置___________(填“能”或“不能”)互换,理由是________________________________。
(4)写出![]() 溶液与CO反应的化学方程式_______________________________________________。
溶液与CO反应的化学方程式_______________________________________________。
(5)为探究草酸钙晶体加热分解产物的成份并测x,进行如下实验:
①按上图连接好仪器,______________________________(填实验操作名称)。
②将29.2g草酸钙晶体放入C中,从a处通入一段时间空气。
③加热草酸钙晶体直到质量不再减少,从a处一直通空气直至冷却。
④测得C中残留固体质量11.2g,D增重3.6g,E增重8.8g(澄清石灰水足量)。
⑤数据处理:计算可得x=_______________;写出上述实验中草酸钙晶体受热分解的化学方程式________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需要配制500 mL 1 mol·L-1硫酸溶液。
(1)需量取质量分数为98%、密度为1.84 g·cm-3的浓硫酸________mL。
有如下操作步骤:
①把量好的浓硫酸沿烧杯壁慢慢注入蒸馏水中,并用玻璃棒搅拌溶解。
②把①所得溶液冷却后小心转入500mL容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(2)操作步骤的正确顺序为______________(填序号)。
(3)本实验必须用到的玻璃仪器有10ml量筒、玻璃棒、烧杯、_________。
(4)下列情况使所配溶液的浓度偏高的是_________
A.某同学观察液面的情况如图所示

B.没有进行操作步骤④;
C.加蒸馏水时不慎超过了刻度线,再吸出一部分水。
D.向容量瓶中转移溶液时(操作步骤②)溶液流到容量瓶外面
(5)若实验过程中出现(4)中D选项情况应如何处理?:________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com