
【题目】研究 NOx、SO2、CO 等大气污染气体的处理具有重要意义.
(1)处理含 CO、SO2 烟道气污染的一种方法是将其在催化剂作用下转化为单质 S.已知:1molCO(g)与适量的 SO2(g)反应生成 S(s)和 CO2(g)时,放出 135kJ 的热量,则此反应的热化学方程式为 .
(2)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体,用 CO(g)处理 NO2(g)的能量转化关系如图所示.
标准状况下,22.4LCO 和 NO2发生上述反应.整个过程中,转移电子的物质的量为mol,放出的热量为kJ(用含有 a 的代数式表示).
(3)用 CH4 催化还原 NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若 1molCH4(g)直接将 NO2(g)还原至 N2(g),整个过程中放出的热量为 867kJ,则△H2= .
A.向水中加入 NaHCO3 固体
B.向水中加入 NaHSO4 固体
C.加热至 100℃
D.向水中加入(NH4)2 SO4固体
(4)若将等 pH、等体积的 NaOH 溶液和 NH3H2O 溶液分别加水稀释 m 倍、n 倍,稀释后两种溶 液的 pH 仍相等,则 mn(填“<”“>”或“=”).
(5)等物质的量浓度的下列溶液:①NaCl ②NaOH ③CH3COOH ④HCl ⑤CH3COONa ⑥Ba(OH)2 , pH 由大到小的顺序为(填序号).
【答案】
(1)CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol
S(s)+CO2(g)△H=﹣135kJ/mol
(2)2,0.025a
(3)﹣1160KJ/mol
(4)<
(5)⑥②⑤①③④
【解析】解:(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol,
S(s)+CO2(g)△H=﹣135kJ/mol,
所以答案是:CO(g)+ ![]() SO2(g)=
SO2(g)= ![]() S(s)+CO2(g)△H=﹣135kJ/mol;(2)发生反应:4CO+2NO2=N2+4CO2,CO物质的量为
S(s)+CO2(g)△H=﹣135kJ/mol;(2)发生反应:4CO+2NO2=N2+4CO2,CO物质的量为 ![]() =1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ×
=1mol,根据C元素化合价变化可知转移电子为1mol×2=2mol;由图可知4mol CO反应时放出热量为a kJ,则0.1mol CO反应放出的热量为a kJ× ![]() =0.025a kJ,
=0.025a kJ,
所以答案是:2;0.025a;(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=﹣574KJmol﹣1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)× ![]() 可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867KJmol﹣1,则(﹣574KJmol﹣1+△H2)×
可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=﹣867KJmol﹣1,则(﹣574KJmol﹣1+△H2)× ![]() =﹣867KJmol﹣1,
=﹣867KJmol﹣1,
解得△H2=﹣1160KJ/mol,
所以答案是:﹣1160KJ/mol;(4)NH3H2O 是弱电解质,NaOH 是强电解质,NH3H2O 存在电离平衡NH3H2ONH4++OH﹣,NaOH 不存在电离平衡,若将等 pH、等体积的 NaOH 溶液和 NH3H2O 溶液分别加水稀释 m 倍、n 倍,稀释后溶液的pH仍然相等,则NaOH 稀释的倍数小于NH3H2O,
所以答案是:<;(5)等物质的量浓度的下列溶液:①NaCl ②NaOH ③CH3COOH ④HCl ⑤CH3COONa ⑥Ba(OH)2,
属于碱的为:⑥Ba(OH)2②NaOH,浓度相同时,碱性及pH为⑥>②;
水解呈碱性的为:⑤CH3COONa,
溶液呈中性的为:①NaCl;
溶液呈酸性的有:③CH3COOH ④HCl,HCl完全电离为一元强酸,CH3COOH 为一元弱酸,浓度相同时,溶液的pH:③>④,
综合以上分析可知,溶液的pH由大到小的顺序是为:⑥②⑤①③④,
所以答案是:⑥②⑤①③④.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】请根据以下装置回答相关问题 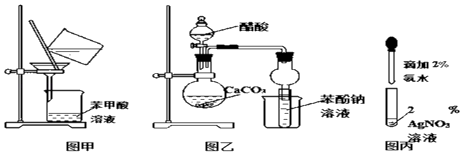
(1)图甲是一套进行操作的装置,可以除去粗苯甲酸中所含的杂质.
(2)利用图乙装置来证明醋酸、碳酸、苯酚酸性的相对强弱时,实验过程中,苯酚钠溶液中所出现的实验现象是 . 该实验中存在的缺陷是未除去(填化学式下同)中可能混有的
(3)图丙是做乙醛的银镜反应前配制银氨溶液的实验操作图.配制过程中,试管内发生变化的现象是 . 配好银氨溶液后,向其中加入乙醛进行银镜反应时,为了获得良好的实验效果,对试管采用的加热方式是 . 乙醛发生银镜反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子最外层电子数是其内层的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且Y原子核外p电子比s电子多5个。
(1)Z基态原子的核外电子排布式为__________。
(2)Z的氧化物是石油化工中重要的催化剂之一,如催化异丙苯(![]() )裂化生成苯和丙烯。
)裂化生成苯和丙烯。
①1mol丙烯分子中含有σ键与π键数目之比为_______。
②苯分子中碳原子轨道的杂化类型为__________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为_______个。
(3)W、X、Y三种元素的电负性由小到大顺序为__________。(请用元素符号回答)
(4)ZY3熔点为1152℃,熔融状态下能够导电,据此可判断ZY3晶体属于__________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图,每个Z原子周围最近的X 原子数目为__________。若该化合物的相对分子质量为M,晶胞边长为acm,阿伏加德罗常数为NA,则该晶体的密度为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol/LKOH溶液滴定10.00mL0.10mol/LH2C2O4(二元弱酸)溶液,所得滴定曲线如图(混合溶液的体积可看成混合前溶液的体积之和).请回答: 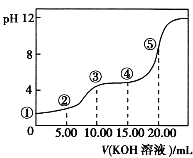
(1)点①所示溶液中,Kw= .
(2)点②所示溶液中的电荷守恒式为 .
(3)点③所示溶液中所有离子的浓度由大到小的顺序为 .
(4)点④所示溶液中的物料守恒式为0.10mol/L= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.乙烯为不饱和烃,分子中6个原子处于同一平面
B.乙炔与溴的四氯化碳溶液发生加成反应而使其褪色
C.乙烯与溴水发生加成反应的产物是CH2CH2Br2
D.等物质的量的甲烷与氯气反应的产物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列问题:
①CaBr2 ②NH4Cl ③H2O2 ④Na2O2 ⑤ HClO ⑥Al
(1)只含有离子键的是(用序号回答,下同)___________________________,并用电子式表示该化合物的形成过程_________________________________________;
(2)含有共价键的离子化合物是__________,并写出其中含有非极性键化合物的电子式___________;
(3)属于共价化合物的是_________________,并写出只含有极性键化合物的电子式___________;
(4)熔融状态能导电的化合物是_________________________________;
(5)熔融状态时和固态时,都能导电的是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应Fe3++AgFe2++Ag+设计成如右图所示的原电池,(盐桥装有琼脂﹣硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)已知,接通后,观察到电流计指针向右偏转.下列判断正确的是( ) 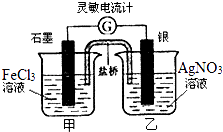
A.在外电路中,电子从石墨电极流向银电极
B.盐桥中的K+移向乙烧杯
C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转
D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com