
����Ŀ��W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�Ԫ��X��ԭ�����������������ڲ��3����Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Y��X��Z����ͬһ���ڣ���Yԭ�Ӻ���p���ӱ�s���Ӷ�5����
(1)Z��̬ԭ�ӵĺ�������Ų�ʽΪ__________��
(2)Z����������ʯ�ͻ�������Ҫ�Ĵ���֮һ����������(![]() )�ѻ����ɱ��ͱ�ϩ��
)�ѻ����ɱ��ͱ�ϩ��
��1mol��ϩ�����к��ЦҼ���м���Ŀ֮��Ϊ_______��
�ڱ�������̼ԭ�ӹ�����ӻ�����Ϊ__________��
��Z��һ��������ZO5�У�Z�Ļ��ϼ�Ϊ+6�������й���������ĿΪ_______����
(3)W��X��Y����Ԫ�صĵ縺����С����˳��Ϊ__________��(����Ԫ�ط��Żش�)
(4)ZY3�۵�Ϊ1152�棬����״̬���ܹ����磬�ݴ˿��ж�ZY3��������__________(�������)��
(5)ZX2����ľ����ṹ��ͼ��ÿ��Zԭ����Χ�����X ԭ����ĿΪ__________�����û��������Է�������ΪM�������߳�Ϊacm�������ӵ�����ΪNA����þ�����ܶ�Ϊ_________g/cm3��

���𰸡� [Ar]3d54s1 8:1 sp2 2 H<Cl<O ���Ӿ��� 6 ![]()
��������W��X��Y��ZΪԭ���������������ǰ������Ԫ�أ�Ԫ��W����������ḻ��Ԫ�أ�W��H��Ԫ��X��ԭ�����������������ڲ��3����X��O��Ԫ��Z�Ļ�̬ԭ�Ӻ��������24���˶�״̬��Z��Cr��Y��X��Z����ͬһ���ڣ�Y�ǵ�������Ԫ�أ�Yԭ�Ӻ���p���ӱ�s���Ӷ�5����Y��Cl��
(1)Cr��̬ԭ�ӵĺ�������Ų�ʽΪ[Ar]3d54s1��(2)�ٵ�������������˫���к���1��������1������������1mol��ϩ���ӣ�CH2��CHCH3���к���������������Ŀ֮��Ϊ8:1���ڱ�������ƽ���νṹ��������̼ԭ�ӹ�����ӻ�����Ϊsp2���������������ĿΪx����2����ԭ�ӵĸ�����5��2x��Cr�Ļ��ϼ�Ϊ+6������������۴�����Ϊ0��֪2x+(5��2x)��2��6�����x��2��(3)�ǽ�����Խǿ���縺��Խ����W��X��Y����Ԫ�صĵ縺����С����˳��ΪH��Cl��O��(4)CrCl3�۵�Ϊ1152�棬����״̬���ܹ����磬�ݴ˿��ж�CrCl3�����������Ӿ��塣(5)���ݾ����ṹ���ж�ÿ��Crԭ����Χ�����Oԭ����ĿΪ6����������Cr��1��8��1/8��2������þ�����ܶ�Ϊ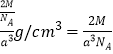 g/cm3��
g/cm3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ����ijþ���Ͻ��ĩ������ɿ���MgxAly��ʾ�������м�������ϡ�����ַ�Ӧ���ռ���3.808L H2����״����ͬʱ����ɫ��Һ����������Һ�м������NaOH��Һ����ַ�Ӧ�õ�����4.64g����x��yΪ
A. 2��1 B. 4��3 C. 1��1 D. 1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������к�ƻ���ף�ƻ������һ����ƻ�����Ͷ��ɵľ��нⶾ����֬�����ʺ�ֹк������ҩЧ�Ľ���ʳƷ��ƻ���ᣨ�����ǻ������ᣩ���������ϵ���Ҫ�������ʣ�ƻ����Ľṹ��ͼ��ʾ���������˵������ȷ���ǣ������� 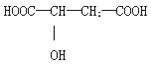
A.ƻ������һ���������ܷ���������Ӧ
B.ƻ������һ���������ܷ�����������Ӧ
C.ƻ������һ���������ܷ�����ȥ��Ӧ
D.ƻ����ܷ������۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��E��F��ԭ��������������A��B�γɵ���̬�������ˮ��Һ�ʼ��ԣ�A��Dͬ���壬B��C���ڣ�F������������Ӧ��ˮ����Ϊ���������е���ǿ�ᡣE��B�ɹ��ɻ�����E3B2���Ҹ�������ˮ����ˮ�ⷴӦ����֪��������װ�����Ʊ�E3B2��װ�â������Ʊ�B���ʡ�����˵��������ǣ� ��
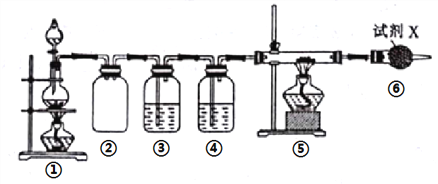
A. E��B�ļ����ӵĵ��Ӳ�ṹ��ͬ�������Ӱ뾶B>E
B. �ۡ��ܡ���������ʢװ���Լ�������NaOH��ҺŨH2SO4����ʯ��
C. A��B��C����Ԫ����ɵĻ����������F������������Ӧ��ˮ���ﷴӦ
D. ʵ�����,ȡ���е������������Թ��У�����������ˮ������ʹ�Թܿ�ʪ��ĺ�ɫʯ����ֽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���NaOH��Һ�ֱ�ӵ�HF��Һ��CH3COOH��Һ�У��������Һ������Ũ����pH�ı仯��ϵ��ͼ��ʾ����֪pKa=-lgKa�������й�����������ǣ� ��
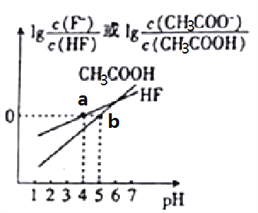
A. ��0.2molL-1CH3COOH��Һ��0��1molL-1NaOH��Һ�������ϣ���Ӧ��Ļ��Һ�У�2c��OH-��+c��CH3COO-��=2c��H+��+c��CH3COOH��
B. a��ʱ��c(F-)=c(HF)>c(Na+)>c(H+)>c(OH-)
C. ������,0��1mol/LNaF��Һ��pH����0��1mol/LCH3COONa��Һ��pH
D. ��CH3COOH��Һ�м���NaOH��Һ�����õĻ����Һ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�����������Ӧ�������¿��ܴ���������ǣ�������
A.��ʹpH��ֽ������Һ�У�CO32����K+��Cl����Na+
B.![]() �T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
�T10��10mol/L����Һ�У�Na+��HCO3����Cl����K+
C.��c��OH����/c��H+��=1��1012����Һ�У�NH4+��Fe2+��Cl����NO3��
D.��ˮ���������c��OH����=1��10��12mol/L����Һ�У�NO3����Mg2+��Na+��SO42
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о� NOx��SO2��CO �ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1�������� CO��SO2 �̵�����Ⱦ��һ�ַ����ǽ����ڴ���������ת��Ϊ���� S����֪��1molCO��g���������� SO2��g����Ӧ���� S��s���� CO2��g��ʱ���ų� 135kJ ����������˷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���壬�� CO��g������ NO2��g��������ת����ϵ��ͼ��ʾ��
��״���£�22.4LCO �� NO2����������Ӧ�����������У�ת�Ƶ��ӵ����ʵ���Ϊmol���ų�������ΪkJ���ú��� a �Ĵ���ʽ��ʾ����
��3���� CH4 ����ԭ NOxҲ�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=��574kJ/mol
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2
�� 1molCH4��g��ֱ�ӽ� NO2��g����ԭ�� N2��g�������������зų�������Ϊ 867kJ�����H2= ��
A����ˮ�м��� NaHCO3 ����
B����ˮ�м��� NaHSO4 ����
C�������� 100��
D����ˮ�м��루NH4��2 SO4����
��4�������� pH��������� NaOH ��Һ�� NH3H2O ��Һ�ֱ��ˮϡ�� m ����n ����ϡ�ͺ������� Һ�� pH ����ȣ��� mn���������������=������
��5�������ʵ���Ũ�ȵ�������Һ����NaCl ��NaOH ��CH3COOH ��HCl ��CH3COONa ��Ba��OH��2 �� pH �ɴ�С��˳��Ϊ������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���߾��L����һ����Դ������ѧ��е�����ճ�ϼ�����ԭ��ȡ����ֲ����ݱ������й��ڸ߾��L����˵��������ȷ����

A. ����֮һΪ![]()
B. ��һ���������ܷ���ˮ�ⷴӦ
C. ����1mol L��ͬʱ�����У�x+y-1��mol H2O����
D. 1mol L������3mol H2�����ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ�����������������ǵ�����������֮��Ϊ21��W��һ�ֺ��س����ڿ��ţ�X��Zͬ���塣X����Ȼ����ȫ���Ի���̬��ʽ���ڡ�����˵����ȷ����
A. W��ͬ��������ֻ��3�� B. �⻯��ķе㣺X>Z>W
C. X���ʿ��Խ�Z���ʴ�������Һ���û����� D. �����Ӱ뾶��X>Y
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com