
����Ŀ�������ʺϵ�����������ӦFe3++AgFe2++Ag+��Ƴ�����ͼ��ʾ��ԭ��أ�������װ����֬���������Һ�����������Ƶ�0�̶Ⱦ��У����Ҿ��п̶ȣ���֪����ͨ�۲쵽������ָ������ƫת�������ж���ȷ���ǣ������� 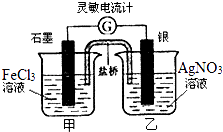
A.�����·�У����Ӵ�ʯī�缫�������缫
B.�����е�K+�������ձ�
C.һ��ʱ�������ָ�뷴��ƫת��Խ��0�̶ȣ������ƫת
D.������ָ����к������ձ��м���һ���������ۣ�������ָ�뽫����ƫת
���𰸡�D
���������⣺A��ԭ������·�����ɸ����������������Ե��Ӵ����缫����ʯī�缫����A����
B����ԭ����У�Agʧ������������ʯī��������������K+�������������������ձ�����B����
C��һ��ʱ���ԭ��ط�Ӧ����������ָ��ָ��0����C����
D��������ָ����к������ձ��м���һ���������ۣ���������ǿ�������γ��µ�ԭ��أ���������������������������ָ������ƫת����D��ȷ��
��ѡ��D��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о� NOx��SO2��CO �ȴ�����Ⱦ����Ĵ���������Ҫ���壮
��1�������� CO��SO2 �̵�����Ⱦ��һ�ַ����ǽ����ڴ���������ת��Ϊ���� S����֪��1molCO��g���������� SO2��g����Ӧ���� S��s���� CO2��g��ʱ���ų� 135kJ ����������˷�Ӧ���Ȼ�ѧ����ʽΪ ��
��2��������������ɹ⻯ѧ�����ͳ�������ĵ���Ҫ���壬�� CO��g������ NO2��g��������ת����ϵ��ͼ��ʾ��
��״���£�22.4LCO �� NO2����������Ӧ�����������У�ת�Ƶ��ӵ����ʵ���Ϊmol���ų�������ΪkJ���ú��� a �Ĵ���ʽ��ʾ����
��3���� CH4 ����ԭ NOxҲ�������������������Ⱦ�����磺
��CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g����H1=��574kJ/mol
��CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g����H2
�� 1molCH4��g��ֱ�ӽ� NO2��g����ԭ�� N2��g�������������зų�������Ϊ 867kJ�����H2= ��
A����ˮ�м��� NaHCO3 ����
B����ˮ�м��� NaHSO4 ����
C�������� 100��
D����ˮ�м��루NH4��2 SO4����
��4�������� pH��������� NaOH ��Һ�� NH3H2O ��Һ�ֱ��ˮϡ�� m ����n ����ϡ�ͺ������� Һ�� pH ����ȣ��� mn���������������=������
��5�������ʵ���Ũ�ȵ�������Һ����NaCl ��NaOH ��CH3COOH ��HCl ��CH3COONa ��Ba��OH��2 �� pH �ɴ�С��˳��Ϊ������ţ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɫ��Һ��SO2���ã�������ɫ����ʵ����ͬ���ǣ� ��
��Ʒ����Һ��KMnO4������Һ����ˮ�ܵ��з�̪��NaOH��Һ�ݵ��۵���Һ
A.�٢�B.�٢ڢ�C.�ڢۢ�D.�ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ԫ��W��X��Y��Z��ԭ�����������������ǵ�����������֮��Ϊ21��W��һ�ֺ��س����ڿ��ţ�X��Zͬ���塣X����Ȼ����ȫ���Ի���̬��ʽ���ڡ�����˵����ȷ����
A. W��ͬ��������ֻ��3�� B. �⻯��ķе㣺X>Z>W
C. X���ʿ��Խ�Z���ʴ�������Һ���û����� D. �����Ӱ뾶��X>Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ�����Ԫ�ص�������ͼ������˵����ȷ���ǣ������� 
A.BiԪ�ص���������209
B.BiԪ�ص����ԭ��������209.0
C.Biԭ��6p�Dz���һ��δ�ɶԵ���
D.Biԭ���������5��������ͬ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���У�����ȷ����
A.�������Ǹ��ϲ���B.ͭ�ڿ����л�����ͭ��
C.�������Ż�ʱ��ʹ��ú�����D.���ǻ��ý��������ڿ�������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����������Ϊ���������ں��º����ܱ������г���һ������NO��NH3����һ�������·�����Ӧ��6NO(g) + 4NH3(g) ![]() 5N2(g) +6H2O(g)��
5N2(g) +6H2O(g)��
����˵���÷�Ӧ�Ѵﵽƽ��״̬�ı�־��_______
a����Ӧ����![]() ( NH3) =
( NH3) =![]() ( N2)
( N2)
b��������ѹǿ������ʱ��������仯
c��������N2�����ʵ�������������ʱ��������仯
d��������n(NO)��n(NH3)��n(N2)��n(H2O) = 6��4��5��6
��ij��ʵ���в��������NO��N2�����ʵ�����ʱ��仯��ͼ��ʾ��ͼ��b���Ӧ�����ʹ�ϵ��![]() (��)____
(��)____![]() (��)�����������������������d���Ӧ�����ʹ�ϵ��
(��)�����������������������d���Ӧ�����ʹ�ϵ��![]() (��)____
(��)____![]() (��)�����������
(��)�����������

��2��298 Kʱ������֪���ɱ�״����2.24 L NH3ʱ�ų�����Ϊ4.62 kJ��д���ϳɰ���Ӧ���Ȼ�ѧ����ʽ_______���ڸ��¶��£�ȡ1 mol N2��3 mol H2����һ�ܱ������У��ڴ�������ʱ���з�Ӧ����÷�Ӧ�ų���������С��92.4 kJ����ԭ����________��
��3��һ�������£���2 L�ܱ������ڣ���Ӧ2NO2(g)![]() N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
N2O4(g) ��H����180 kJ��mol��1��n(NO2)��ʱ��仯���±���
ʱ��/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 0.040 | 0.020 | 0.010 | 0.005 | 0.005 | 0.005 |
���� | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
Ũ��mol/L | 4��10-6 | 6��10-6 | 2��10-5 | 4��10-5 | 3��10-5 | 2��10-5 |
���ݱ��������ж�������pH=_________��
��2������β����NOx��CO�����ɣ�
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)![]() 2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
2NO(g) ��H>0���£������ܱ������У�����˵������˵���÷�Ӧ�ﵽ��ѧƽ��״̬����____
A.���������ܶȲ��ٱ仯 B.��������ƽ�����������ٱ仯
C.N2��O2��NO�����ʵ���֮��Ϊ1��1��2 D.�����İٷֺ������ٱ仯
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)����֪�÷�Ӧ�ġ�H��0����������ܷ�ʵ��______________����ܡ����ܡ���
��3��Ϊ����SO2���ŷţ�����ȡ�Ĵ�ʩ�У�
�ٽ�úת��Ϊ�������ȼ�ϡ���֪��
H2(g)+ 1/2O2(g) =H2O(g) ��H=��241.8kJ��mol-1
C(s)+1/2O2(g) =CO(g)��H =-110.5kJ��mol-1
д����̿��ˮ������Ӧ���Ȼ�ѧ����ʽ��___________________��
��ϴ�Ӻ�SO2��������
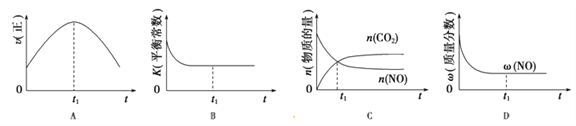
��4������β����������Ҫԭ����2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
2CO2(g)+N2(g)����H��0�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬����_________������ţ�������ͼ��v����K��n��w�ֱ��ʾ����Ӧ���ʡ�ƽ�ⳣ�������ʵ���������������
�����ŷŵĵ������úȼ�ղ����Ķ��������ǵ������������ġ�������ס�֮һ������̿�ɴ���������Ⱦ��NO����5L�ܱ������м���NO�ͻ���̿�����������ʣ���һ����������������E��F�����¶ȷֱ���T1���T2��ʱ����ø�����ƽ��ʱ���ʵ�����n/mol�����±���
���� �¶�/�� | ����̿ | NO | E | F |
��ʼ | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
��1��д��NO�����̿��Ӧ�Ļ�ѧ����ʽ______________________��
��2������������ӦT1��ʱ��ƽ�ⳣ��K1=__________________����T1��T2����÷�Ӧ�ġ�H__________________0(���������������������
��3��������ӦT1��ʱ�ﵽ��ѧƽ�����ͨ��0.1molNO���壬��ﵽ�»�ѧƽ��ʱNO��ת����Ϊ________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com