
 FeO(s) + CO(g),其温度与平衡常数K的关系如下表:
FeO(s) + CO(g),其温度与平衡常数K的关系如下表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
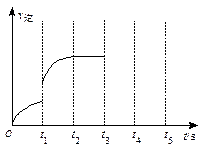
 画出t3~ t5时间段的v逆变化曲线。
画出t3~ t5时间段的v逆变化曲线。 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源:不详 题型:单选题
 C(g)+2D(g),在恒温恒容条件下分别进行下列两种操作:
C(g)+2D(g),在恒温恒容条件下分别进行下列两种操作:| A.两种操作均到达平衡后,操作Ⅰ中的B的转化率与操作Ⅱ中C的转化率之和为100% |
| B.n=1 |
| C.m=1 |
D.若A(g)+2B(g) C(g)+2D(g);⊿H>0,在t0时刻达到平衡,增大压强,其速率变化符合图示规律的图 C(g)+2D(g);⊿H>0,在t0时刻达到平衡,增大压强,其速率变化符合图示规律的图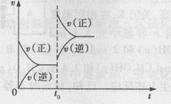 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (由煤和水蒸气高温制得)应用的新方法,如:
(由煤和水蒸气高温制得)应用的新方法,如:  和
和 在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。
在443—473K的温度下用钴作催化剂,可合成碳原子数为5—8的烷烃。 的化学方程式
的化学方程式 ,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是
,当完全反应时,气压降至原来的2/5,(温度不变),此时 (填“有”或“没有”)汽油生成,理由是  的体积比的取值范围是
的体积比的取值范围是  ,以n表示
,以n表示 和
和 的物质的量之比,a表示
的物质的量之比,a表示 的转化率,x表示达到反应限度时混合物中
的转化率,x表示达到反应限度时混合物中 的体积分数,则
的体积分数,则 、a、x的关系式为 。
、a、x的关系式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。
Fe(s)+CO2(g)(正反应为吸热反应),其平衡常数可表达为K=[CO2]/[CO],已知,1 100 ℃时,K=0.263。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g)经5 min后达到平衡,测得此时A的浓度减少了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( )
pC(g)+qD(g)经5 min后达到平衡,测得此时A的浓度减少了a mol·L-1,而C的浓度增加了2/3a mol·L-1,又测得平均反应速率v(C)=2v(B),达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为( ) 3C(g)+5D(g) B.3A(g)+B(g)
3C(g)+5D(g) B.3A(g)+B(g) 2C(g)+2D(g)
2C(g)+2D(g) 2C(g)+D(g) D.A(g)+3B(g)
2C(g)+D(g) D.A(g)+3B(g) 2C(g)+2D(g)
2C(g)+2D(g)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
 的依据是 (填序号字母)
的依据是 (填序号字母) N2(g)+3H2(g)的化学平衡常数的值为 。
N2(g)+3H2(g)的化学平衡常数的值为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2HI (g)达平衡的是
2HI (g)达平衡的是| A.单位时间内消耗amol H2,同时消耗 2amol HI |
| B.容器内的总压强不随时间变化 |
| C.容器内H2、I2不再减少,HI不再增加 |
| D.单位时间内每生成amol HI,同时a NA个HI分子分解 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g) + H2(g);1molCO完全反应放热a kJ。反应达到平衡后,测得n(CO2)= 0.8mol下列说法正确的是( )
CO2(g) + H2(g);1molCO完全反应放热a kJ。反应达到平衡后,测得n(CO2)= 0.8mol下列说法正确的是( )| A.判断该反应达到平衡的依据是CO、H2O、CO2、H2的浓度都相等 |
| B.反应放出的热量为0.4a kJ |
| C.平衡时H2O 的转化率为40% |
| D.加入催化剂可以反应加快,放热更多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com