
【题目】根据下列实验操作和现象,能得出正确结论的是

A.AB.BC.CD.D
科目:高中化学 来源: 题型:
【题目】3,5﹣二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成,一种以间苯三酚为原料的合成反应如下:
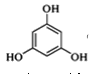 +2CH3OH
+2CH3OH +2H2O
+2H2O
甲醇、乙醚和3,5﹣二甲氧基苯酚的部分物理性质见下表:

(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。
①分离出甲醇的操作是__。
②萃取用到的分液漏斗使用前需__洗净,分液时有机层在分液漏斗的__填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是__,用饱和食盐水洗涤的目的是__。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是__(填字母)。
a.蒸馏除去乙醚 b.重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

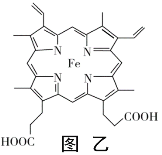
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的绝热密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
A.混合气体的密度不变B.体系温度不变
C.3v逆(NH3)=2v正(H2)D.N2和NH3的浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关叙述正确的是
A.常温常压下,18g甲烷(14CH4)所含的中子数为9NA
B.25℃时,pH=7的纯水中含OH-的数目为10-7NA
C.铜与浓硝酸反应生成NO2、N2O4共23g,则铜失去的电子数为0.5NA
D.密闭容器中2mol NO与1mol O2充分反应,所得产物的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据AgCl、Ag2CrO4的溶度积可得到下图,测量溶液中Cl-的量,常使用AgNO3溶液滴定,Na2CrO4作指示剂。下列表述错误的是
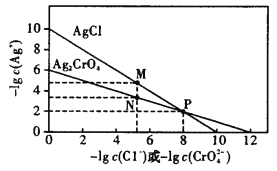
A.由图可知,Ag2CrO4的溶度积小于AgCl的溶度积
B.由图可知,作Cl-的滴定指示剂时,Na2CrO4的浓度不能过大
C.由图可知,只有当c(Ag+)>10-2mol·L-1时,![]() 先沉淀
先沉淀
D.不采用AgNO3溶液滴定测量溶液中I-的量,因为生成的AgI胶体会大量吸附I-,使滴定终点提前
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)为二元弱酸,25℃时,向Na2HPO3溶液中滴入盐酸,混合溶液中的有关粒子浓度之比的对数与溶液pH的关系如图所示,下列叙述正确的是

A.M、W两点所在的直线表示pH与![]() 的变化关系
的变化关系
B.当溶液呈中性时,可能存在:c(Na+)>c(![]() )+2c(
)+2c(![]() )
)
C.图中N点表示加入的HCl的物质的量与原溶液中Na2HPO3物质的量相等
D.25℃时,![]() +H2O
+H2O![]()
![]() +OH-的平衡常数为1.0×10-12.57
+OH-的平衡常数为1.0×10-12.57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
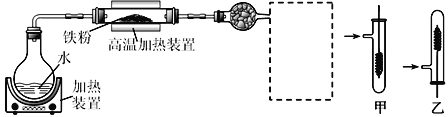
(1)写出在高温加热装置中发生的反应的化学方程式___________
(2)虚线框处宜选择的装置是_____(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________。
(3)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_________溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由________
实验二:绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关![]() 和
和![]() ,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。
,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。

实验步骤如下:(1)_______,(2)点燃酒精灯,加热,(3)________,(4)_______,(5)________,(6)称量A,重复上述操作步骤,直至A恒重,记为m3g。
(4)请将下列实验步骤的编号填写在对应步骤的横线上。
a. 关闭![]() 和
和![]() b. 熄灭酒精灯 c. 打开
b. 熄灭酒精灯 c. 打开![]() 和
和![]() 缓缓通入
缓缓通入![]() d. 冷却至室温
d. 冷却至室温
(5)必须要进行恒重操作的原因是_______________。
(6)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解,根据实验记录,计算绿矾化学式中结晶水数目X=____________(用含m1、m2、m3的列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com