
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

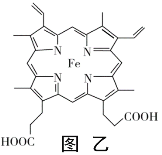
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
【答案】[Ar]3d5(或1s22s22p63s23p63d5) CO2或CS2 1∶1 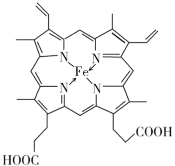 六方最密堆积 c 12 12NAaρ
六方最密堆积 c 12 12NAaρ
【解析】
(1)铁是26号元素,其原子核外有26个电子,根据构造原理其核外电子排布式为[Ar]3d64s2,则Fe3+的基态核外电子排布式为[Ar]3d5(或1s22s22p63s23p63d5);
(2)SCN中含有3个原子,且其价电子数是16,与SCN互为等电子体的一种非极性分子的为CO2(或CS2);
(3)每隔一个立方体中心有一个钾离子,所以一个晶胞中钾离子个数=![]() =0.5,该立方体中铁原子个数=8×
=0.5,该立方体中铁原子个数=8×![]() =1,CN位于每条棱中点,该立方体中含有CN个数=12×
=1,CN位于每条棱中点,该立方体中含有CN个数=12×![]() =3,所以平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,所以亚铁离子与铁离子之比是1:1;
=3,所以平均化学式是K0.5Fe(CN)3,Fe平均化合价2.5,所以亚铁离子与铁离子之比是1:1;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,Fe2+提供空轨道,N原子提供电子对,Fe2+与N原子间的的配位键为: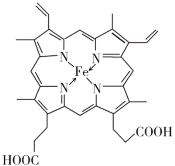 ;
;
(5)镁单质晶体中原子的堆积方式是按ABABABAB…的方式堆积,单质晶体中原子为六方最密堆积,配位数为12,晶胞是图中的c;紧邻的四个镁原子的中心连线构成的几何体为正四面体,正四面体的该高为晶胞的![]() ,可推知四面体的体积为整个晶胞的
,可推知四面体的体积为整个晶胞的![]() ,而晶胞中含有的镁原子数为1+
,而晶胞中含有的镁原子数为1+![]() =2,则晶胞质量=2
=2,则晶胞质量=2![]() g,则ρg·cm3=
g,则ρg·cm3=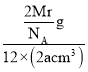 ,则有Mr=12NAaρ。
,则有Mr=12NAaρ。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】钛被称为继铁、铝之后的第三金属,其常见的化合物有钙钛矿、硫酸氧钛(TiOSO4)、钛酸(H2TiO3)、二氧化钛(TiO2)、四氯化钛(TiCl4)等,回答下列问题:
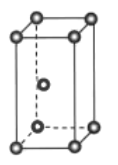
(1)基态钛原子的价层电子排布式为______,金属钛晶体的晶胞结构如图所示,其堆积方式名称为______。
(2)硫酸氧钛的阳离子为TiO2+,其阴离子的VSEPR模型名称为______。TiOSO4在水溶液中不稳定,易生成钛酸沉淀,该反应化学方程式为______。
(3)纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图:
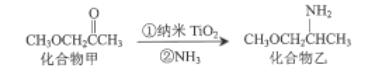
化合物乙种C、N、O元素的第一电离能由大到小的顺序为______。化合物甲的沸点低于化合物乙的沸点,主要原因是______。
(4)已知TiCl4在通常情况下是无色液体,熔点为-37℃,沸点为136℃,由此可知TiCl4为______晶体。将TiCl4加入盐酸中,经处理可得到一种配位数为6的绿色晶体TiCl36H2O,1mol该晶体恰好与含2molAgNO3的溶液反应得到白色沉淀,则该绿色晶体中配离子的化学式为______。
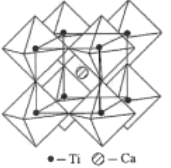
(5)钙钛矿的一种晶体结构如图所示。Ti位于立方晶胞的顶点,每个Ti被6个O包围成配位八面体,Ca位于立方晶胞的体心,与Ca距离最近的O有______个;若Ca与Ti的最近核间距为apm,阿伏伽德罗常数为NA,则此钙钛矿的密度为______gcm-3.(列出计算式即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生产生活中的常见有机物的分子式、结构式、结构简式或名称有关说法正确的是
①![]() ②
②![]() ③
③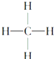 ④
④ ⑤CH3CH2OH
⑤CH3CH2OH
⑥C6H12O6⑦CH3COOH ⑧硬脂酸甘油酯 ⑨蛋白质 ⑩聚乙烯
A. 能跟溴的四氯化碳溶液发生加成反应并使之褪色的有①②④⑩
B. 投入钠能产生H2的是⑤⑦⑧⑨
C. 属于高分子材料的是⑧⑨⑩
D. 含碳量最高、有毒、常温下为液体且点燃时有浓烟的是①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是

A.原子半径:W<X<Y
B.元素的非金属性:Z>Y>X
C.化合物XZ2中所有原子均满足8电子稳定结构
D.X、 Z的单质分别直接与Y的单质反应,都能生成两种氧化物。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“奥司他韦”是化学家们合成的药品,能抗病毒,用于治疗流感。于2001年在我国投入使用。其合成路线如下

已知: +H2O
+H2O
(1)莽草酸的含氧官能团名称有:__________,反应③的反应类型:_________。
(2)反应①的反应试剂和反应条件:_____________________ 。
(3)请写出反应②的化学方程式:____________________________________ 。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_____种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有_____个手性碳。
(6)设计由对甲基苯甲醛制备对醛基苯甲酸![]() 的合成路线_________________
的合成路线_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[Fe(C5H5)2]可作为燃料的节能消烟剂、抗爆剂。二茂铁的电化学制备装置与原理如图所示,下列说法正确的是

A.a为电源的正极
B.电解质溶液是NaBr水溶液和DMF溶液的混合液
C.电解池的总反应化学方程式为
D.二茂铁制备过程中阴极的电极反应为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
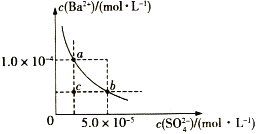
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com