
【题目】如图所示为某温度时BaSO4的沉淀溶解平衡曲线,下列说法不正确的是( )
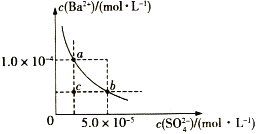
A.加入Na2SO4(s)可使溶液由a点变为b点
B.在曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
C.蒸发溶剂可能使溶液由c点变为曲线上a、b之间的某一点(不含a、b)
D.升高温度,可使溶液由b点变为c点
科目:高中化学 来源: 题型:
【题目】铁系元素是人体必需的微量元素, Fe3+可以与KSCN溶液、苯酚等发生显色作用。镁元素也是人体所必需的阳离子元素之一,它能够维持核酸结构的稳定性,调节机体免疫功能,对人体抵抗新冠病毒等病毒侵袭起着重要作用。
(1)Fe3+的基态核外电子排布式为____________________。
(2)与SCN互为等电子体且为非极性分子的化学式为__________(任写一种)。
(3)普鲁士蓝俗称铁蓝,晶胞如图甲所示(K+未画出),平均每两个晶胞立方体中含有一个K+,又知该晶体中铁元素有+2价和+3价两种,则Fe3+与Fe2+的个数比为_________。

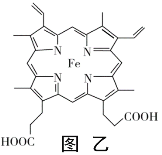
(4)血红素铁(图乙)用作铁强化剂,其吸收率比一般铁剂高3倍,在图乙中画出Fe2+与N原子间的化学键(若是配位键,需要用箭头加以表示)______________


(5)镁单质晶体中原子的堆积模型如图,它的堆积模型名称为____________;晶胞是图中的_________________(填a、b或c);配位数是__________________;紧邻的四个镁原子的中心连线构成的正四面体几何体的体积是2a cm3,镁单质的密度为ρ g·cm-3,已知阿伏伏德罗常数为NA,则镁的摩尔质量的计算式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)为二元弱酸,25℃时,向Na2HPO3溶液中滴入盐酸,混合溶液中的有关粒子浓度之比的对数与溶液pH的关系如图所示,下列叙述正确的是

A.M、W两点所在的直线表示pH与![]() 的变化关系
的变化关系
B.当溶液呈中性时,可能存在:c(Na+)>c(![]() )+2c(
)+2c(![]() )
)
C.图中N点表示加入的HCl的物质的量与原溶液中Na2HPO3物质的量相等
D.25℃时,![]() +H2O
+H2O![]()
![]() +OH-的平衡常数为1.0×10-12.57
+OH-的平衡常数为1.0×10-12.57
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究铁、铜及其化合物的性质,某同学设计并进行了下列两组实验。
实验一:
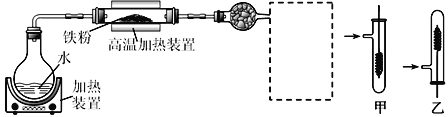
(1)写出在高温加热装置中发生的反应的化学方程式___________
(2)虚线框处宜选择的装置是_____(填“甲”或“乙”);实验时应先将螺旋状铜丝加热,变黑后再趁热迅速伸入所制得的纯净氢气中,观察到的实验现象是_________________。
(3)实验后,为检验硬质玻璃管中的固体是否含+3价的铁元素,该同学取一定量的固体并用一定浓度的盐酸溶解,滴加_________溶液(填试剂名称或化学式),没有出现血红色,说明该固体中没有+3价的铁元素。请你判断该同学的结论是否正确并说明理由________
实验二:绿矾是含有一定量结晶水的硫酸亚铁,为测定绿矾中结晶水含量,将石英玻璃管(带两端开关![]() 和
和![]() ,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。
,设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g,B为干燥管。按图连接好装置进行实验。

实验步骤如下:(1)_______,(2)点燃酒精灯,加热,(3)________,(4)_______,(5)________,(6)称量A,重复上述操作步骤,直至A恒重,记为m3g。
(4)请将下列实验步骤的编号填写在对应步骤的横线上。
a. 关闭![]() 和
和![]() b. 熄灭酒精灯 c. 打开
b. 熄灭酒精灯 c. 打开![]() 和
和![]() 缓缓通入
缓缓通入![]() d. 冷却至室温
d. 冷却至室温
(5)必须要进行恒重操作的原因是_______________。
(6)已知在上述实验条件下,绿矾受热只是失去结晶水,硫酸亚铁本身不会分解,根据实验记录,计算绿矾化学式中结晶水数目X=____________(用含m1、m2、m3的列式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1100℃时,在体积固定且为5L的密闭容器中,发生可逆反应:![]() 并达到平衡。
并达到平衡。
(1)平衡后,向容器中充入1mol![]() ,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
,平衡向___________(填“正反应方向”、“逆反应方向”或“不移动”),重新达到平衡后,与原平衡相比,逆反应速率________(填“增大”、“减小”或“不变”)。
(2)若混合气体的密度不变,(填“能”或“不能”)______判断该反应达已经到平衡状态。若初始时加入的![]() 为2.84g,10分钟后达到平衡时
为2.84g,10分钟后达到平衡时![]() 的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,
的转化率(参加反应的碳酸钠占加入硫酸钠总质量的百分比)为45%,![]() ________。
________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组用镍触媒废料(主要成分为Ni-Al合金,混有少量Fe、Cu、Zn及有机物) 制备NiO并回收金属资源的流程如下所示:

已知:相关数据如表1和表2所示
表1部分难溶电解质的溶度积常数(25℃)
物质 | Ksp | 物质 | Ksp |
Fe(OH)3 | 4.0×10-38 | CuS | 6.3×10-34 |
Fe(OH)2 | 1.8×10-16 | ZnS | 1.6×10-24 |
Al(OH)3 | 1.0×10-33 | NiS | 3.2×10-18 |
Ni(OH)2 | 2.0×10-15 |
表2 原料价格表
物质 | 价格/(元吨-1) |
漂液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
请回答下列问题:
(1)“焙烧”的目的是________________________________。
(2)“试剂a”的名称为__________________;选择该试剂的理由是______。
(3)“氧化”时反应的离子方程式为__________________________________________。
(4)欲使溶液中Fe3+和A13+的浓度均小于等于1.0×10-6 mol L-1,需“调节pH”至少为_______________。
(5)“试剂b”应选择__________,“加水煮沸”时,反应的化学方程式为_______________________________。
(6)氢镍电池是一种应用广泛的二次电池,放电时,该电池的总反应为NiOOH+MH=Ni(OH)2+M,当导线中流过2 mol电子时,理论上负极质量减少__________g。充电时的阳极反应式为_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E五种元素,原子序数依次增大。A是短周期中原子半径最大的元素,B元素3p能级半充满;C是所在周期电负性最大的元素;D是第四周期未成对电子最多的元素;E的原子序数比D大3。试回答下列有关的问题:
(1)写出D元素价电子的电子排布图:______________。
(2)D可形成化合物[D(H2O)6](NO3)3 ,[D(H2O)6](NO3)3中阴离子的立体构型是____________。NO2-中心原子的轨道杂化类型为______________,1 mol [D(H2O)6] 3+ 中含有的σ键数为 ______________。
(3)已知B、C两种元素形成的化合物通常有两种。这两种化合物中___________ (填化学式)为非极性分子。另一种物质的电子式为 ______________。
(4)D是一种硬而脆抗腐蚀性强的金属,常用于电镀和制造特种钢。下图为D的晶胞结构图,则D晶胞属于___________堆积;该晶胞中原子的体积占晶胞体积的百分率为___________。(已知:π=3.14,![]() =1.732)
=1.732)

(5)E晶体的一种晶胞(如图所示)的边长为anm,密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则E的原子半径为___________nm,E的相对原子质量可表示为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过学习,同学们对宏观辨识与微观探析,变化观念与平衡思想等学科素养有了进一步的认识和理解。请根据所学知识回答下列问题:
(1)铅蓄电池是典型的可充电型电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
2PbSO4 +2H2O。放电时,负极的电极反应式是_______;充电时,当外电路通过 0.2 mol 电子时,理论上正极板的质量减少_________g。
(2)已知:常温下,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4×10-38。
①常温下,某酸性 MgCl2 溶液中含有少量的 FeCl3 ,为了得到纯净的 MgCl2·2H2O 晶体,应加入_________填化学式),调节溶液的 pH=4,使溶液中的 Fe3+转化为 Fe(OH)3沉淀,此时溶液中的 c(Fe3+)=_________mol·L-1。
②常温下,若将 0.01 mol·L-1 MgCl2 溶液与至少________mol·L-1 NaOH 溶液等体积混合时有沉淀生成。
(3)25℃时,几种离子开始沉淀时的 pH 如下表:
离子 | Fe2+ | Cu2+ | Mg2+ |
pH | 7.6 | 5.2 | 10.4 |
当向含相同浓度 Cu2+、Mg2+、Fe2+的溶液中滴加 NaOH 溶液时,__________先沉淀(填离子符号),要使 0.3mol·L-1 硫酸铜溶液中Cu2+沉淀较为完全(当 Cu2+浓度降至 10-5 mol·L-1时),则应向溶液里加入氢氧化钠溶液使溶液 pH 为________(KspCu(OH)2=1×10-20)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T1温度时在容积为2L的恒容密闭容器中只充入1.00molNO2气体发生反应:2NO(g)+O2(g)![]() 2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
2NO2(g) H<0。实验测得:v正=k正c2(NO)·c(O2),v逆=k逆c2(NO2),k正、k逆为速率常数只受温度影响。不同时刻测得容器中n(NO2)如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO2)/mol | 1.00 | 0.80 | 0.65 | 0.55 | 0.50 | 0.50 |
(1)从0~2s该反应的平均速率v(NO2)=__。
(2)T1温度时化学平衡常数K=__L·mol-1。
(3)化学平衡常数K与速率常数k正、k逆的数学关系是K=__。若将容器的温度改变为T2时其k正=k逆,则T2__T1(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com