
| 0.02mol |
| 0.02L |
| 0.112L |
| 22.4L/mol |
| 0.015mol |
| 0.03L |


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:

| A、分离Na2CO3溶液和CCl4,选④ |
| B、用CC14提取碘水中的碘,选③ |
| C、用FeC12溶液吸收C12,选⑤ |
| D、粗盐提纯,选①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入KSCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- |
| B、1mol?L-1的烧碱溶液中:O2、CO32-、SO42-、K+ |
| C、硫酸铜溶液中:Na+、Ba2+、NO3-、Cl- |
| D、含有大量HCO3-的澄清透明溶液中:K+、NO3-、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 盐酸体积mL | NaOH溶液体积读数(mL) | 消耗NaOH溶液的平均体积(mL) | |
| 滴定前 | 滴定后 | |||
| 1 | 20.00 | 0.00 | 16.26 | |
| 2 | 20.00 | 0.00 | 16.30 | |
| 3 | 20.00 | 0.02 | 16.24 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
 在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+
在分析化学中常用Na2C2O4晶体作为基准物质测定KMnO4溶液的浓度.在H2SO4溶液中,反应如下:2MnO4-+5C2O42-+16H+
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
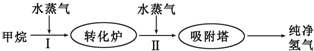

| 温度/℃ | 400 | 500 | 830 |
| 平衡常数K | 10 | 9 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
A、 装置可用于定量测定H2O2的分解速率 装置可用于定量测定H2O2的分解速率 |
B、 装置制备Fe(OH)2并能较长时间观察其颜色 装置制备Fe(OH)2并能较长时间观察其颜色 |
C、 装置测量Cu与浓硝酸反应产生气体的体积 装置测量Cu与浓硝酸反应产生气体的体积 |
D、 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 装置可用于蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
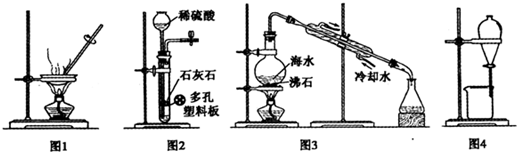
| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com