
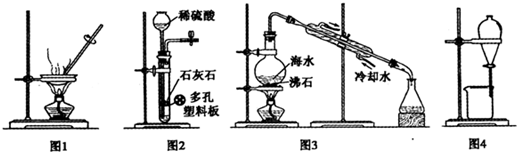
| A、用图1装置蒸干CuCl2饱和溶液制备CuCl2晶体 |
| B、用图2装置制取二氧化碳气体 |
| C、用图3装置蒸馏海水制取少量淡水 |
| D、用图4装置分离乙醇与乙酸乙酯的混合物 |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 复方冬青油软膏具有强力迅速镇痛作用.其有效成分的分子模型如图.下列说法中不正确的是( )
复方冬青油软膏具有强力迅速镇痛作用.其有效成分的分子模型如图.下列说法中不正确的是( )| A、该有机物中含氧元素的质量分数最小 |
| B、该有机物分子中氢、氧原子的个数比为8:3 |
| C、该有机物完全燃烧生成二氧化碳和水 |
| D、该有机物的化学式为C8H8O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.8g Na2O2中含有的离子总数目为0.4NA |
| B、1mol苯分子中含有碳碳双键数目为3NA |
| C、标准状况下,将分子总数为NA的NH3和HCl气体混合后的体积约为22.4L |
| D、16g CH4与18g NH4+所含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、少量NaHSO4溶液与Ba(OH)2溶液混合:S
| ||
| B、醋酸除水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O | ||
| C、漂白粉溶液中通入过量的CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | ||
| D、少量金属钠放入冷水中:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+)=1.0×10-12mol?L-1的溶液:K+、Mg2+、CH3COO-、Br- |
| B、甲基橙呈红色的溶液:NH4+、Ba2+、NO3-、Cl- |
| C、与铝反应产生大量氢气的溶液Na+、K+、CO32-、NO3- |
| D、含1.0mol?L-1 KNO3的溶液Cl-、SO42-、H+、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液中由水电离出的c(H+),前者是后者的10m-n倍 |
| B、25℃时等浓度的CH3COONa和NaCN溶液,后者pH大 |
| C、HCN溶液和NaOH溶液混合后一定存在:c(H+)-c(OH-)=c (CN-)-c(Na+) |
| D、常温下将pH相同的CH3COOH和HCN溶液稀释相同的倍数时,前者pH变化小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
| 催化剂 |

查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E分别表示四种二价金属元素符号,它们的氢氧化物均难溶于水,右图是该四种难溶氢氧化物在不同pH下溶解度曲线(S/mol?L-1).请回答:
A、B、C、D、E分别表示四种二价金属元素符号,它们的氢氧化物均难溶于水,右图是该四种难溶氢氧化物在不同pH下溶解度曲线(S/mol?L-1).请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com