
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
| 127 |
| x |
| 6 |
| 0.02L×0.001mol/L |
| 42.3×10-5×1000mg |
| w×10-3kg |
| 4.2×102 |
| w |
| 4.2×102 |
| w |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、工业酒精中含有乙醇和甲醇 |
| B、煤中含有苯和甲苯 |
| C、天然油脂中含有高级脂肪酸甘油酯 |
| D、许多水果中含有酯类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该装置实现化学能转变为电能 |
| B、该装置中Cu2+向Zn电极移动 |
| C、该装置外电路中电子由Zn棒转移到Cu棒 |
| D、该装置中Zn棒上的电极反应为:Zn-2e-═Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
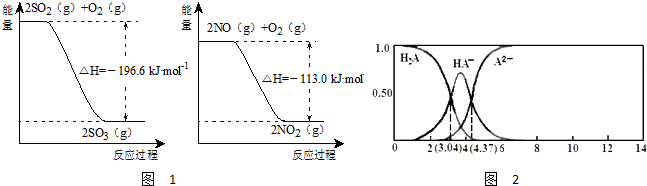
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P: 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 ②
② ③
③ ④
④
 (结构如图所示)的正确组合为( )
(结构如图所示)的正确组合为( )| A、①②④ | B、①②⑤ |
| C、②④⑤ | D、③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com