
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P: 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
 H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
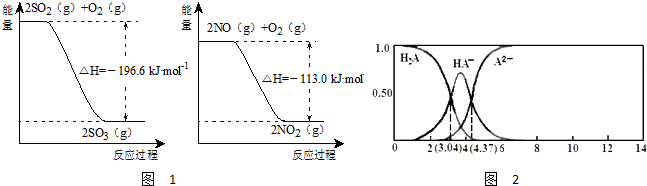
 H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=| c(A2-)?c(H+) |
| c(HA-) |
 2SO3(g)△H=-196.6kJ?mol-1,
2SO3(g)△H=-196.6kJ?mol-1, 2NO2(g)△H=-113.0kJ?mol-1,
2NO2(g)△H=-113.0kJ?mol-1,| ①-② |
| 2 |
| -196.6kJ/mol-(-113.0kJ/mol) |
| 2 |
| 5 |
| 7 |
| 1 |
| 1+a |
 H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以
H++A2-,当溶液中加入少量NaOH溶液时,与H+与反应,平衡正向移动,HA-浓度变小,A2-浓度变大,H+浓度变小,所以| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
 H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=
H++A2-,当溶液PH=4.37时,据图可知c(HA-)=c(A2-),此时Ka2=| c(A2-)?c(H+) |
| c(HA-) |


科目:高中化学 来源: 题型:
| A、室温下,10L,pH=13的NaOH溶液中含有Na+的数目为NA |
| B、常温常压下,17g氨气中含有氢原子的数目为NA |
| C、1mol/L的Na2SO3溶液1L加热蒸干得到固体产物转移的电子数目为4NA |
| D、体积为1L、物质的量浓度为1mol?L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气体的密度不再增大 |
| B、混合气体中A的体积分数不再变化 |
| C、混合气体的总压不再变化 |
| D、单位时间内生成a mol A,同时生成3a mol B |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量 | 35±15mg/kg |
| 储藏方法 | 密封、避光、防潮 |
| 食用方法 | 烹饪时,待食品熟后加入碘盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图,A是一种非金属单质,E是一种白色沉淀.据图填空:
如图,A是一种非金属单质,E是一种白色沉淀.据图填空:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.图是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
|
| 3 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com