


科目:高中化学 来源: 题型:
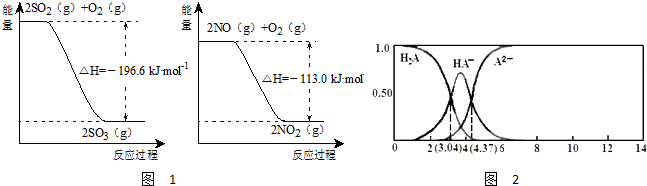
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P: 100kPa |
5 | 5.6 | 6.4 | 6.8 | 7 | 7 |
| c(A2-) |
| c(HA-) |
| c(H+) |
| c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是(填序号)
(1)下列物质中,其核磁共振氢谱中给出的峰值(信号)只有一个的是(填序号)
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | ③ | |||||
| ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ②
② ③
③ ④
④
 (结构如图所示)的正确组合为( )
(结构如图所示)的正确组合为( )| A、①②④ | B、①②⑤ |
| C、②④⑤ | D、③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有SO42-或Ag+或其中一种 |
| B、可能含有SO42-或Ag+,不含SO32- |
| C、一定含有SO42-或SO32-或Ag+ |
| D、可能含有SO42-、SO32-、Ag+其中一种或两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子中含有6个碳碳双键 |
| B、1mol联苯最多可以和6mol H2发生加成反应 |
| C、它容易发生加成反应、取代反应,也容易被强氧化剂氧化 |
D、它和蒽( )同属于芳香烃,两者互为同系物 )同属于芳香烃,两者互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤的干馏是加热使煤分解的过程 |
| B、煤的干馏是化学变化,石油的分馏是物理变化 |
| C、煤干馏的目的是为了得到煤焦油 |
| D、煤是以单质碳为主的复杂混合物,干馏时单质碳与混合的物质发生化学变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com