
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如下图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。 “纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”的诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与金刚石互为同分异构体
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法不正确的是( )

A. 含有M元素的化合物均可与强酸、强碱反应
B. 原子半径Z<X<M
C. Z2与Z3互为同素异形体
D. Y的最高价氧化物对应水化物的酸性比X的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质和条件己略去)。A是由两种元素组成的难溶于水的物质,摩尔质量为88 g·mol-l;B是常见的强酸;C是一种气态氢化物;气体E能使带火星的木条复燃;F是最常见的无色液体;无色气体G能使品红溶液褪色;向含有I的溶液中滴加KSCN试剂,溶液出现血红色。请回答下列问题:

(1)G的化学式为_________________________。
(2)C的电子式为________________________。
(3)写出反应①的离子方程式:_____________________。
(4)写出反应②的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水合肼(N2H4·H2O)又名水合联氨,无色透明,具有腐蚀性和强还原性的碱性液体,它是一种重要的化工试剂。利用尿素法生产水合肼的原理为:CO(NH2)2+2NaOH+NaC1O=Na2CO3+N2H4·H2O+NaCl
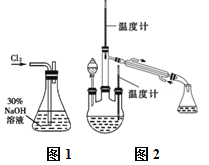
实验一:制备NaClO溶液。(实验装置如图1所示)
(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有______(填标号)。
A.玻璃棒 B.烧杯 C.烧瓶 D.容量瓶 E.胶头滴管
(2)锥形瓶中发生反应的离子方程式是___________________。
实验二:制取水合肼。(实验装置如图2所示)
(3)①仪器A的名称为_______________。
②反应过程中需控制反应温度,同时将分液漏斗中溶液缓慢滴入A中,如果滴速过快则会导致产品产率降低,同时产生大量氮气,写出该过程的化学反应方程式:__________,故分液漏斗中的溶液是______(填标号)。
A.CO(NH2)2溶液 B.NaOH和NaClO
③充分反应后,加热蒸馏A内的溶液,收集108~114℃馏分,即可得到水合肼的粗产品。
实验三:测定馏分中肼含量。
(4)称取馏分5.0g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL置于锥形瓶中,并滴加23滴淀粉溶液,用0.10mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O)
①滴定时,碘的标准溶液盛放在______(填"酸式”或“碱式”)滴定管中,本实验滴定终点的现象为____________________。
②实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质重分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物CxHmOn完全燃烧时需要氧气的物质的量是该有机物的x倍,则该有机物分子式中x、m、n的关系不可能是( )
A. x:m:n=1:2:1 B. m:n=2:1 C. m>2x+2 D. m≤2x+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是( )
A. 第三周期第ⅥB族;p区B. 第三周期第ⅢB族;ds区
C. 第四周期第ⅥB族;d区D. 第四周期第ⅢB族;f区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下的恒容密闭容器中,反应A2(g)+B2(g)![]() 2AB(g)达到平衡的标志是
2AB(g)达到平衡的标志是
A. 每断裂1molA-A键,同时也断裂1molB-B键
B. 浓度之比c(A2): c(B2): c(AB)=1:1:2
C. 各物质的浓度不再改变
D. 当混合物的密度不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环境监测显示,某地市的主要气体污染物为SO2,NOx,CO等,其主要来源为燃煤、机动车尾气。进行如下研究:
(1)为减少燃煤对SO2的排放,可将煤转化为清洁燃料水煤气(CO和H2)。
已知:H2(g)+1/2O2(g)=H2O(g)△H=-241.8kJ/mol
C(s)+1/2O2(g)=CO(g)△H=-110.5kJ/mol
写出焦炭与水蒸气反应的热化学方程式______;
(2)汽车尾气中NO是在发动机气缸中生成的,反成为:N 2(g)+O 2(g) ![]() 2NO(g) △H>0
2NO(g) △H>0
①将含0.8 mol N2和0.2molO2(近似空气组成)的混合气体充入某密闭容器中,保持1300℃反应达到平衡,测得生成8×10-4molNO 。计算该温度下此反应的化学平衡常数K=_______(填近似计算结果)。
②汽车启动后,汽缸内温度越高,单位时问内NO排放最越大,原因是______________。
(3)利用如图所示装置(电极均为惰性电极)可吸收SO2,并利用阴极排出的溶液吸收NO2。

①电极A的电极反应式为________________;电极B的电极反应式为_____________。
②碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时生成SO32-。该反应的离子方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com